
ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Гиалуроновая кислота в лечении ран и ожогов
Матчин Е.Н.
Потапов В.Л.
Строителев В.В.
Федорищев И.А.
ГУЗ ТО Тульская областная больница, ожоговый центр
Тульский государственный университет, НПП «Тульская индустрия Ltd.»
Гиалуроновая кислота (ГК), несульфатированный гликозаминогликан, является неразветвленным полисахаридом, состоящим из дисахаридных единиц, образованных N-ацетил-D-глюкозамином и D-глюкуроновой кислотой, соединенных между собой b-1,3- и b-1,4-гликозидными связями. В организме человека гиалуроновая кислота встречается повсеместно в виде натриевой соли (гиалуроната натрия), являясь одним из основных компонентов экстрацеллюлярного матрикса (ЭЦМ), стекловидного тела глаза и синовиальной жидкости. В коже наличие гиалуроновой кислоты впервые показано К.Мейером в 1948 году [15]. К настоящему времени установлено, что кожа (как эпидермис, так и дерма) относятся к числу тканей с наибольшим содержанием гиалуроната (табл.1), который во многом определяет не только структуру, но свойства и функционирование кожного покрова.
Полисахаридные цепи ГК слишком негибкие для того, чтобы свернуться в компактные глобулярные структуры, которые типичны для полипептидных цепей. Кроме того, ввиду наличия карбоксильных групп, ГК имеет выраженный отрицательный заряд и высоко гидрофильна. Она имеет тенденцию принимать расширенные конформации, которые занимают огромный объем относительно ее массы, и образует гели даже при очень низких концентрациях. Высокая плотность ее отрицательных зарядов притягивает массу катионов, таких как Na+, которые являются осмотически активными и вызывают поступление большого количества воды в матрикс. Это создает давление набухания или тургор, который дает возможность матриксу противостоять силам сжатия (в противоположность коллагеновым фибриллам, которые обусловливают резистентность силам растяжения). Характерно, что по мере старения кожи ГК переходит из своего свободного в связанное с белками состояние, которое обладает значительно меньшей водоудерживающей способностью. Это приводит к снижению содержания воды в коже, она становится более сухой, дряблой, появляются морщины и складки.
Если в дерме ГК образует каркас, к которому присоединяются другие гликозаминогликаны (и прежде всего хондроитинсульфат) и белки, называемые за их способность специфически связываться с ГК гиалатгеринами, с образованием полимерной сети, которая заполняет большую часть экстрацеллюлярного пространства, обеспечивая механическую поддержку тканей и быструю диффузию водорастворимых молекул и миграцию клеток, то в эпидермисе ГК локализуется в перицеллюлярном пространстве, создавая ареол, окружающий клетку и защищающий ее от действия токсичных веществ [19].
За период, прошедший со времени открытия ГК (1934 год) [16], произошел переход от первоначальной точки зрения, согласно которой ГК является пассивным структурным компонентом ЭЦМ, обеспечивающим в частности непроницаемость кожных покровов для микробов и токсинов, к признанию того, что эта широко распространенная макромолекула динамически включается во многие биологические процессы: от модуляции клеточной миграции и дифференцировки в течение эмбриогенеза до регуляции процессов организации и метаболизма ЭЦМ и важной роли в процессах заживления ран, воспаления и метастазирования.
Исследования ГК показали, что уникальность этого вещества заключается также и в том, что молекулы ГК с различной длиной полисахаридной цепи оказывают разные эффекты на клеточное поведение. Короткие цепи ГК (с мол. массой менее 30000) оказывают провоспалительное действие, вследствие чего от этой фракции освобождаются. Высокомолекулярная ГК (с мол. массой более 500000) подавляет ангиогенез, ингибирует клеточную миграцию и пролиферацию, а также продукцию интерлейкина-1b и простагландина Е2, вследствие чего она нашла широкое применение в офтальмологии и лечении посттравматических и дегенеративных артритов. И лишь фракция ГК с мол. массой 50000-100000 обладает нужными для заживления ран свойствами: способностью стимулировать клеточную миграцию и пролиферацию. Эта фракция была названа «Гиаластин» [11] и составляет примерно 50% от общей ГК.
|
Таблица 1 Ткань |
Концентрация гиалуроната |
| Амниотическая жидкость (16-20 недель беременности) | 20 мг/мл |
| Гребни кур | до 7,5 мг/мл |
| Пупочный канатик | 4 мг/мл |
| Синовиальная жидкость | 3-4 мг/мл |
| Гиалиновый хрящ | 1 мг/г сырой ткани |
| Дерма | 0,5 мг/г сырой ткани |
| Стекловидное тело человеческого глаза | 0,1-0,4 мг/г сырой ткани |
| Эпидермис | 0,1 мг/г сырой ткани |
Гиалуронат играет важную роль в заживлении повреждений кожи
В первые сутки нормального заживления ран отмечается увеличение концентрации гиалуроновой кислоты [13]. ГК связывается с фибриновой сетью, образуя переходный матрикс, который стимулирует активацию гранулоцитов, макрофагов и фибробластов [12]. Благодаря созданию влажной среды на раневой поверхности улучшается перенос факторов роста, освобождающихся из клеток, усиливается миграция фибробластов и пролиферация эпителиальных клеток. Мелкие молекулы ГК, образующиеся при распаде и перестройке матрикса, обладают действием, усиливающим ангиогенез [22].
Взаимодействие ГК с клетками осуществляется при участии рецепторов CD44 и RHAMM, специфически связывающихся с ГК. Состояние этих рецепторов существенным образом отражается на скорости заживления повреждений кожи. У трансгенных мышей с подавленной экспрессией RHAMM или CD44 в эпидермальных кератиноцитах наблюдается позднее заживление ран, что свидетельствует о важной роли ГК в заживлении ран и вовлечении рецепторов ГК в сигнальные пути, обеспечивающие процессы репарации.
Первый в мире опыт применения (неочищенной) гиалуроновой кислоты в медицине относится к 1943 году, когда Н.Ф.Гамалея использовал ее в комплексных повязках для обмороженных красноармейцев в военно-полевом госпитале N 1321. Экстракт из пуповины, названный им «фактором регенерации» [2], был впоследствии утвержден Минздравом СССР в качестве препарата под названием «Регенератор». К настоящему времени описано получение очищенной ГК [6, 8], что позволило создать на ее основе ряд препаратов, нашедших широкое применение в косметике, заживлении ран и лечении ряда кожных заболеваний [18].
Особенностью перевязочных средств, содержащих ГК, является не просто создание на поверхности раны вязкого слоя с кислотными свойствами, механически изолирующего ее поверхность от внешней среды, но обладающего биостимулирующим эффектом, ускоряющим регенеративные процессы при длительно незаживающих трофических язвах, пролежнях, ранах после травм и оперативных вмешательств [1].
Эти и другие (см. ниже) качества ГК послужили основанием для создания на базе очищенной ГК ряда раневых покрытий (табл.2). Первое Российское медицинское изделие со стандартизованной кислотой — «Гиаплюс»Т- впервые создано НПП «Тульская индустрия Ltd.» совместно с НПФ «Новые медицинские технологии» (Москва) (ТУ — 9358- 004- 12466809- 96). Помимо ГК в состав «Гиаплюс» входят местный анестетик, антиоксидант и антисептик растительного происхождения. Ингредиенты подбирались таким образом, чтобы дополнять и усиливать эффекты друг друга: введение анестетика в композицию позволяет купировать боль в ране, а также снимать зуд при сопутствующих дерматозах; антиоксидант стабилизирует эндогенную антиоксидантную систему и, тормозя развитие свободнорадикального перекисного окисления липидов биомембран и других клеточных структур, ограничивает зону вторичного некроза в ранах, а также предупреждает расщепление ГК по свободнорадикальному механизму; антисептик растительного происхождения усиливает антимикробное действие ГК, оказывая благоприятное влияние на заживление гнойных ран.
Препарат прошел токсикологическую экспертизу и рекомендован к применению МЗ РФ (Р.98/219 — 86 — 1).
|
Таблица 2 |
|||
|
Торговая марка |
Компания |
Страна |
Форма выпуска |
| Johnson & Johnson | США | раневое покрытие | |
| Куриозин® | Гедеон Рихтер | Венгерская республика | капли |
| HydacTM | BioCoat | США | раневое покрытие |
| SurModics Inc. | США | раствор | |
| Гиаплюс® | Тульская индустрия Ltd | Россия | раневое покрытие |
Клинические испытания салфеток «Гиаплюс»Т, проводившиеся в течение 5 лет в лечебных учреждениях Министерства здравоохранения РФ и Министерства обороны РФ, показали высокую эффективность в комплексном лечении ожогов, гнойных и огнестрельных ран, трофических язв, пролежней и постлучевых поражений кожи, при выполнении хирургических операций пластического характера с целью профилактики келоидообразования и формирования косметического послеоперационного рубца.
Хорошие результаты достигнуты при применении салфеток с гиалуроновой кислотой у ожоговых больных. ГК оказывает противовоспалительный эффект, уменьшает отечность, при курсовом применении снижает количество микробных тел в ожоговых ранах и повышает к концу курса чувствительность микрофлоры к антибактериальным препаратам.
В ожоговом отделении Тульской областной больницы, исполняющего функции регионарного ожогового центра, нами с 1996 года изучалась эффективность местного применения повязок «ГИАЛЮКС», содержащих гиалуроновую кислоту у 311 больных в возрасте от 4 месяцев до 88 лет. Мужчин было 202, женщин 109. У 57 больных имелись поверхностные ожоги II-IIIА степени, у 254 были глубокие ожоги на площади от 2 до 60% поверхности тела.
У 57 больных с поверхностными ожогами повязки «ГИАЛЮКС» накладывались после туалета ожоговой поверхности. Края салфетки, пропитанные гиалуроновой кислотой, должны перекрывать рану не менее чем по 2 см на каждую сторону и находится на здоровых участках кожи. В зависимости от течения раневого процесса смена повязок производилась через 1-2 суток. В среднем заживление наступало к 10-14 суткам после получения ожога.
У 235 больных с глубокими ожогами повязки «ГИАЛЮКС» применяли при подготовке ожоговых ран к кожной пластике.
Изучение цитологического состава раневых отпечатков в динамике указывает на уменьшение числа дегенеративных форм нейтрофилов и увеличение количества полибластов и макрофагов. Под влиянием гиалуроновой кислоты грануляционная ткань под повязкой сама начинает активно бороться с бактериальной обсемененостью.
Под влиянием повязок «ГИАЛЮКС» улучшался общий вид ожоговой раны. При избыточном росте гипертрофических грануляций значительно уменьшалась их отечность и рыхлость, они становились более плоскими не так сильно выступали над поверхностью раны, уменьшалось количество гнойного отделяемого из них. Устранялись микроциркуляторные нарушения в ожоговой ране. Грануляции становились яркими, мелкозернистыми, активизировалась краевая эпителизация в местах пограничного ожога Ш А ст. пролиферация эпидермиса в неповрежденных островках придатков кожи.
В целях ускорения сроков эпителизации в ячейках сетчатого трансплантата нами у 19 больных проводилось наложение повязки «ГИАЛЮКС» поверх сетчатого трансплантата, распластанного на гранулирующей ране после аутопластики с коэффициентом растяжения 1:6. Средние сроки эпителизации с применением повязок «ГИАЛЮКС» сократились с 22,5+1,5 до 17,2+1,1 дней.
В качестве примера местного стимулирующего действия препаратов содержащих ГК можно привести клинический случай. Больной С. 15 лет находился на лечении в Тульском ожоговом центре с диагнозом: Термический ожог пламенем IIIБ ст. лица, шеи, туловища, в/конечностей 45% поверхности тела. Ожог верхних дыхательных путей. Ожоговая болезнь.
Течение раневого процесса после проведения пластики расщепленнымисетчатыми трансплантатами осложнилось лизисом пересаженной кожи см. рисунок 1. В качестве перевязочного средства применены салфетки «ГИАПЛЮС». Лизис пересаженных лоскутов остановился, началась активная краевая эпителизация, см. рисунок 2.
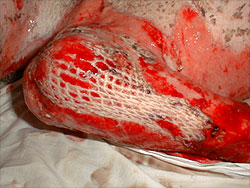
Рисунок 1. Лизис сетчатого трансплантата (1:4) на ожоговой ране.
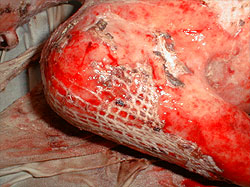
Рисунок 2. Третьи сутки после применения повязки с ГК у того же больного.
Применение ГК при подготовке ожоговых ран к кожной пластике обеспечивает приживление кожного лоскута по всей поверхности с хорошим косметическим эффектом, а также ускорение заживления ран донорских мест [4].
Заключение
Современные перевязочные средства многочисленны и разнообразны [5]. Однако, думается, что повязки с ГК займут среди них достойное место. Эта точка зрения базируется не только на наличии у ГК выраженной биологической активности, но в немалой степени на отсутствии антигенности (ГК является гаптеном), аллергенности (начиная с хордовых и кончая млекопитающими молекула ГК не претерпела изменений), а также местного раздражающего действия, что обусловливает прекрасную биосовместимость ГК и возможность ее применения у больных, сенсибилизированных к другим местным средствам. При этом ГК может использоваться в перевязочных средствах как в качестве основного действующего вещества, обладающего ранозаживляющим действием, так и в комбинации с другими веществами. Перспективным, в частности, представляется защитное покрытие, состоящее из альгинатов и гиалуроновой кислоты [10]. Пленки, образованные по предложенной технологии, обладают прозрачностью, гибкостью, хорошими механическими свойствами, низкой адгезивностью к раневой поверхности, проницаемы для газов, но не проницаемы для жидкости и бактерий. Эксперименты на крысах-самцах линии Sprague-Dawley показали, что применение таких пленок при лечении ожогов сокращает область повреждения, ускоряет отпадение струпа и неоваскуляризацию.
В последние годы наметилась тенденция к созданию раневых покрытий путем комбинаций ГК с белками — ламинином, фибронектином (или замещающими их RGD-пептидами) или коллагеном [20], являющимися естественными компонентами базальной мембраны. Такой подход позволяет осуществлять более скорое и эффективное восстановление целостности базальной мембраны, лежащей на границе эпидермиса и дермы и служащей местом прикрепления клеток эпидермиса.
Идеальная репарация, наблюдаемая в первом и втором триместрах эмбрионального развития — отсутствие шрамов и других следов на коже плода после выполнения хирургических операций [3], вновь и вновь заставляет ученых создавать композиции, близкие по своему составу амниотической жидкости [21]. С развитием техники безопасного амниоцентеза состав амниотической жидкости был изучен и показано наличие в ней большого количества гиалуроновой кислоты и фибронектина. Установлено, что динамика изменения концентрации ГК в раневом экссудате у взрослого и плода имеет существенные различия. Если заживление ран у взрослого характеризуется значительно повышенным уровнем ГК в течение первых трех дней и падением вплоть до нуля к 7 дню, то у плода содержание ГК в раневой жидкости значительно повышено в течение 3 недель, что создает благоприятные условия для полного заживления раны. Именно поэтому с этими двумя соединениями (фибронектином и гиалуроновой кислотой) связывают в первую очередь уникальные ранозаживляющие свойства амниотической жидкости. Искусственная «амниотическая жидкость» призвана создать влажную среду заживления, которая моделирует фетальное заживление ран in utero.
Наконец, химически модифицированные биодеградируемые производные ГК могут быть использованы для создания искусственной кожи или кожных трансплантатов. Предпочтительное использование для этой цели производных ГК определяется быстрым метаболизмом, которому подвергается в коже нативная ГК (период полураспада ГК в эпидермисе составляет менее 1 дня). В отличие от нативной химически модифицированная ГК в меньшей степени доступна для гиалуронидазы и поэтому имеет больший период жизни при сохранении своих биологических свойств.
Включение гиалуроната в состав искусственной кожи из коллаген-желатиновой губки ускоряло врастание внутрь грануляции, обеспечивая таким образом более подходящее ложе для поддержки кожного трансплантата. Дальнейшее исследование гиалуроната, ковалентно связанного с коллагеновой матрицей, показало существенное уменьшенное сокращение коллагена в культурах фибробласта, указывая на важную роль гиалуроната в биоматериалах для кожных заменителей.
Химически модифицированная ГК, в виде губки с определенным размером пор, может быть использована как матрица для заселения клетками, такими как фибробласты или кератиноциты, с последующим использованием в качестве кожных трансплантатов.
Литература
- Волков В.Г., Строителев В.В., Федорищев И.А. Применение искусственного покрытия «Гиаплюс» в лечении трофических язв нижних конечностей// Вестник новых медицинских технологий. — 2000.- Т.7, N1.- С.101-102.
- Гамалея Н.Ф. Фактор регенерации и неспецифическая терапия// Госпит. дело.-1946, N 1-2, С.22-25.
- Марголина А.А., Эрнандес Е.И., Сеньоре Ж.-М. «Клеточная терапия в косметологии». Москва, Изд. «Косметика и медицина», 1999. 176 c.
- Матчин Е.Н., Потапов В.Л. Применение повязок, содержащих гиалуроновую кислоту, в комплексном лечении обожженных: Информационное письмо. Тула, 1998. 13c.
- Морган Д.А. Современные средства для лечения ран (обзор)// Биосовместимость.-1993.-Т.1, N3.-С.161-173.
- Федорищев И.А., Чернышов А.А., Епифанов А.Е. Способ получения гиалуроновой кислоты. Патент РФ N 2157381; 1999. Опубликован 10.10.2000 Бюлл. «Изобретения» N 28.
- Asculai S. S., Hochman D., Purschke D. et al. Formulations containing hyaluronic acid. Patent US N 5990096; 1999.
- Balazs E. Ultrapure hyaluronic acid and the use thereof. Patent US N 4141973; 1979.
- Brown T.J., Alcorn D., Fraser J.R. Absorption of hyaluronan applied to the surface of intact skin// J. Invest. Dermatol.- 1999.-V.113, N5.- P.740-746.
- Della Valle F., Rastrelli A., Calderini G., Romeo A. Preparation of highly hydrated self-supporting hyaluronic acid containing films. Patent US N 5618561; 1997.
- Della Valle F., Romeo A. Hyaluronic acid fractions having pharmaceutical activity, and pharmaceutical compositions containing the same. Patent US N 5925626; 1999.
- Frost, S., and Weigel, P. Binding of hyaluronic acid to mammalian fibrinogens// Biochim. Biophys. Acta.- 1990.-V.1034.- P. 39-45.
- Goa K.I., Benfield P. Hyaluronic acid. A review of its pharmacology and use as a surgical aid in ophtalmology and its therapeutic potential in joint disease and wound healing// Drugs.- 1994.-V. 47, N3.- P.536-566.
- Ikeya H., Kitagawa H. Hyaluronic acid and its salt for treating skin diseases. Patent US N 5728391; 1998.
- Meyer K. Highly viscous sodium hyaluronate// J. Biol. Chem.-1948.- V.176, N2.-P.993-997.
- Meyer K., Palmer J.W. The polysaccharide of the vitreous humor// J. Biol. Chem.-1934.- V.107.-P.629-634.
- Prestwich G.D., Marecak D.M. Functionalized derivatives of hyaluronic acid Patent US N 5874417; 1999.
- Prestwich G.D., Vercruysse K.P. Therapeutic application of hyaluronic acid and hyaluronan derivatives// PSTT.-1998.-V.1, N1.-P.42-43.
- Scott J.E., Presti D. Hyaluronan-mediated protective effect against cell damage caused by enzymatically produced hydroxyl radicals is dependent on hyaluronan molecular mass// Cell Biochemistry and Function.- 1994.-V.12.-P.281-288.
- Silver F. H., Berg R. A., Doillon. C. J. et al. Biodegradable matrix and methods for producing same. Patent US N 4970298; 1990.
- Taylor-McCord D. Wound therapeutic mixture containing medical grade hyaluronic acid and tissue culture grade plasma-fibronectin in a delivery system that creates a moist environment which simulates in utero healing. Patent US 5604200; 1997.
- West D.C., Hampson I.N., Arnold F., Kumar S. Angiogenesis induced by degradation products of hyaluronic acid// Science.- 1985.-V.228.- P.1324-1326.
Designed by Сайт на Заказ