ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Хирургическое лечение ожогов у детей младшего возраста в периоде ожогового шока
Самойленко Г.Е.
Кафедра комбустиологии, пластической хирургии и урологии ФПО Донецкого государственного медицинского университета им. М.Горького, Украина
Конец ХХ, начало ХХI века ознаменовались прогрессивным уменьшением детской смертности от ожогов, но проблема профилактики осложнений течения ожоговой болезни остаётся актуальной. Несмотря на современные возможности лечения, обожженные дети, которые перенесли тяжёлый ожоговый шок рискуют умереть от сепсиса на фоне полиорганной недостаточности (ПОН).
Стресс, вызванный ожогом, влияет на центры гипоталамуса и гипофиза, которые реагируют выбросом гормонов в попытке помочь организму справиться с повреждением, тем самим увеличить вероятность выживания. Стресс-гормоны потенциально влияют на развитие послеожоговых осложненийчерез синтез и выброс цитокинов [2]. Важно отметить, что регуляторное, адаптивное влияние этих субстанций относительно местной реакции направлено на увеличение вероятности выживания, однако чрезмерные их уровни вызывают системные реакции срыва компенсации, которые приводят к ПОН [3, 4].
Таким образом, любой подход к лечению, направленный на предупреждение инициации ПОН, есть приоритетным. В этой связи мы, оставаясь сторонниками раннего хирургического лечения, стремимся к его началу уже в периоде ожогового шока.
Цель работы: оценка эффективности оперативного лечения ожогов у детей младшего возраста в периоде ожогового шока путем изучения динамики основных стрессовых гормонов, изучения состояния системы микроциркуляции, уровня эндогенной интоксикации и оценки структуры дисфункции органов и систем для предотвращения ПОН и неблагоприятного результата ожогового повреждения.
Материал и методы исследования. Для подтверждения обоснованности активной хирургической тактики лечения нами проанализированы результаты лечения 457 детей в возрасте от 1 месяца до 7 лет с ожогами, сопровождавшимися развитием ожоговой болезни различной степени тяжести, госпитализированных в Донецкий ожоговый центр с 1996 года по 2006 год. Больных разделили на три группы исследования.
I (основную) группу исследования составили 159 детей, лечившихся в клинике за последние три года. Все пациенты подвергались очищению ран от лишенных жизнеспособности слоёв кожи под общим обезболиванием и их закрытию уже в периоде ожогового шока в первые-вторые сутки после травмы (96% оперированы сразу при поступлении в клинику спустя несколько часов после ожога).
II группа — 134 пострадавших от ожогов детей, которым оперативное лечение проводилось в ранний период, но после выхода из состояния ожогового шока.
III группа — 164 обожжённых с ожоговой болезнью, которым оперативное лечение проводилось после этапного очищения ран.
Наиболее травмоопасным является возраст от одного до трёх лет (54,3%). Именно в период познавательной активности в этом возрасте дети остаются одни без присмотра родителей. Другие возрастные категории страдают примерно поровну.
Ведущими в этиологии поражений у детей остаются ожоги горячими жидкостями, которые являются самой распространенной причиной травмы, сопровождающейся развитием ожоговой болезни у маленьких детей (89,72%). Из них общий удельный вес только ошпаривания составляет 57,7%, дополняясь ожогами пищей и другими горячими жидкостями (таблица 1).
Таблица N1.Этиология ожогов у детей младших возрастных групп.
|
Возраст |
Кипяток (n=410) |
Пламя(n=40) |
Электроожог (n=4) |
Химический (n=2) |
Контактный (n=1) |
| До 1 года |
104 |
6 |
1 |
- |
1 |
| От 1 до 3 лет |
227 |
21 |
- |
- |
|
| От 3 до 7 лет |
79 |
13 |
3 |
2 |
.
Соотношение количества травмированных мальчиков и девочек по нашим данным составляет 1,57:1. Дети младших возрастных групп получали ожоги преимущественно в вечернее время около 20-22 часов, хотя более логичным было предположить, что более опасно время приготовления пищи, когда дети с родителями могут находиться на кухне. Наиболее неблагоприятными днями недели оказались понедельник – 26%, воскресенье и вторник – по 18% случаев
Немаловажным для течения и исхода ожоговой болезни считаем значение локализации повреждений. Так, особую опасность представляют поражения головы, туловища, промежности ввиду быстрой бактериальной контаминации из этих зон даже при поверхностных ожогах, а ожоги грудной клетки чреваты развитием пневмонического процесса.
У детей младшего возраста преобладают множественные поражения различных участков тела, особенно верхней половины туловища, головы, рук, тогда как локализация повреждений у более старших детей приближалась к таковой у взрослых с преобладанием поражения конечностей.
Благодаря внедрению новой концепции системы этапного лечения обожжённых, особенно детей, сложившейся в Донецком регионе, срок госпитализации пострадавших преимущественно составил первые-вторые сутки с момента травмы.
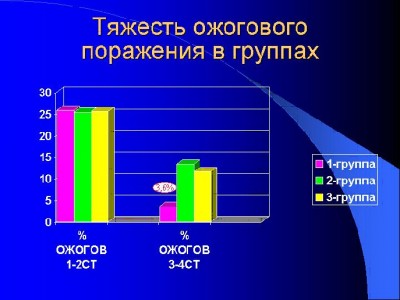
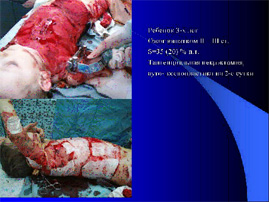
Ожоговая болезнь развилась у всех исследуемых в соответствии с площадью повреждения кожного покрова. Общая площадь поражения составила от 10 % поверхности тела (TBSA) до 80 % поверхности тела и подсчитывалась согласно записей врачей при поступлении пострадавшего и согласно окончательного диагноза при выписке из стационара. Так, при поступлении в клинику согласно предварительному диагнозу общая площадь ожога и в среднем составила в I группе – 28,67 ± 1,49 % (глубокого поражения III- IV степени* – 14,83% поверхности тела), во II группе — 29,23 % поверхности тела (глубокого – 15,18% поверхности тела), а в III группе 27,95% поверхности тела ( глубокого – 15,37% поверхности тела). Таким образом сформированные группы в возрастных категориях и по тяжести ожогового поражения достоверно не отличаются и практически однородны.
Несколько иная картина предстаёт при оценке окончательного клинического диагноза, и если во второй и третьей группах результаты оказались сопоставимыми и средняя общая площадь ожога составила во II группе — 25,43 ± 1,33 % поверхности тела (глубокого – 13,38 ± 0,66 % поверхности тела), а в III группе 25,65 ± 1,39 % поверхности тела ( глубокого – 11,64 ± 0,49 % поверхности тела), то в I группе сходным оказалась лишь цифра площади общего поражения – 25,84 ± 1,45 %, а площадь глубокого поражения оказалась достоверно меньшей - 3,63 ± 0,39% поверхности тела (p < 0,01).
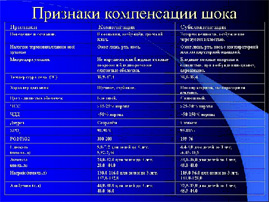
Для оценки гормонального статуса определяли сывороточный уровень тиреотропного гормона гипофиза (ТТГ), гормонов щитовидной железы — трийодтиронина (Т3), тироксина (Т4), инсулина, кортизола. Радиоиммунологическое определение гормонов в сыворотке крови проводилось с использованием сертифицированных наборов реактивов. Всем больным круглые сутки проводился мониторинг основных параметров гемодинамики (артериального давления, ЦВД, почасового диуреза, ЧСС, пульсоксиметрия), функциональных показателей. Диагноз шок устанавливался по клинике нарушения гемодинамики, периферического кровообращения, низкой температуре тела, развития олигоанурии.
Исследования микроциркуляторного кровообращения проводили на лазерном допплеровськом флоуметре ЛАКК — 02 при поступлении в стационар и интраоперационно в нескольких участках, расположенных от центра к периферии а также в ожоговой ране до и после ее хирургического иссечения.
Прикладная компьютерная программа позволяла получить следующие показатели, производные от индекса микроциркуляции: среднее арифметическое значение, среднее квадратичное отклонение и коэффициент вариации. Частотные составные, проанализированные в 6 диапазонах, позволили оценить характер преобладающей регуляции капиллярного кровообращения [1].
Синдром системного воспалительного ответа (ССВО) определяли по наличию 2 и больше признаков по R.Bone (1992). Наличие полиорганной недостаточности (ПОН) по L. Doughty (1996). Диагноз сепсис устанавливался на основании признаков ССВО в сочетании с верификацией возбудителя патогенной флоры в крови.
Полученные результаты и их обсуждениe
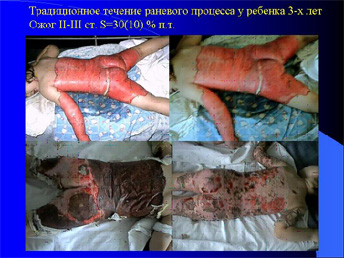
Если тяжёлая ожоговая травма превышает порог необходимой адаптации, наступает фаза истощения. В результате происходит стрессовое повреждение различных органов, в том числе и вторичные изменения в ожоговой ране. Традиционные методы противошоковой терапии и местного лечения не предотвращают патологических нарушений.
Всем детям на фоне противошоковой терапии, стабилизации гемодинамики в первые часы после ожога под общим обезболиванием проводим дермабразию ожоговых ран І-ІІ степени глубины электродерматомом или ножом Hamby вне зависимости от их площади. Раневую поверхность тотально закрываем подготовленными лиофилизированными кожными ксенодермотрансплантатами производства ОАО «Комбустиолог» (г.Тернополь).
При дермабразии поражённая поверхность обильно санировалась, используя 1% раствор хлоргексидина и лишенные жизнеспособности ткани удалялись. Гемостаз достигался прижатием марли с хлоргексидин-адреналиновым раствором (в концентрации 1:1000). Гемотрансфузии не потребовались ни одному пациенту. Дермабразия и закрытие ран проводилась тотально независимо от площади поражения. После проведения операции все раны закрывали подготовленными в кондиционированной с факторами роста среде лиофилизированными ксенодермотрансплантатами с наложением повязки мази антисептика и эластическим бандажем. Бандаж удалялся в последующий день.
Зачастую в первые сутки после операции вследствие изменения вектора транскапиллярного транспорта жидкости из раны, ликвидации плазмопотери отмечали симптомы ранней токсемии в виде гипертермии, которая имела управляемое течение и была ограничена во времени до 12 часов.
Отсутствие периода «открытых ран» благоприятно сказывалось на течении ожоговой болезни. Первичную адгезию ксенокожи фиксировали в течение 48 часов, она принимала розовый оттенок и практически исключала болевой синдром.
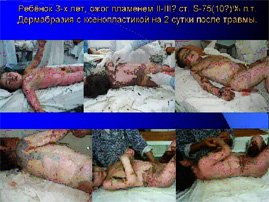
При поражениях ІІІ степени до 5-10% поверхности тела выполняем тангенциаьную или секвенциальную некрэктомию ножом Hamby или электронекротомом с одновременной кожной аутодермопластикой. В первую очередь под жгутами оперируем раны конечностей. При большей площади поражения ІІІ степени или иссечении ран меньшей степени глубины, аутодермопластика выполняется только на функционально значимые участки (крупные суставы, места возможной пункции центральных вен).
Считаем, что в детской комбустиологии обособленная некрэктомия уже имеет историческое значение, и должна выполняться лишь в сочетании с методами временного или постоянного закрытия дефекта.
До последнего времени проведение операций в периоде ожогового шока считалось невыполнимым, что связывали с усугублением клинических проявлений последнего. Нами проведено исследование микроциркуляторного кровообращения на лазерном допплеровском флоуметре у детей, госпитализированных в клинику в состоянии шока при поступлении и интраоперационно.
Было установлено, что при легком ожоговом шоке и шоке средней тяжести первично отмечалось снижение средней величины перфузии (М = 7,82 ед. и 4,68 Ед. соответственно). Значительное снижение средней величины перфузии отмечалось у потерпевших с клиникой тяжёлого ожогового шока М = 2,05 Ед. При изучении частотного анализа допплерограмм, компьютерный анализ форми показал, що по мере ухудшения состояния обожжённых отмечается заметное прогрессирующее уменьшение фактора резерва микроциркуляции, а тип кровообращения можно оценить как спастичесний или спастико-атонический для легкого ожогового шока и шока средней тяжести, и атонический при клинике тяжёлого ожогового шока.
Парадоксальную ситуацию отмечали после дермабразии или секвенциального иссечения ожоговых ран, когда уровень перфузии пострадавших тка-ней, в особенности непосредственно в ране, резко возрастал интраоперационно, достигая М=15,84±4,59 Ед. Одновременное тотальное закрытие раневой поверхности кожными ксенодермотрансплантатами позволял сохранить перфузию неповрежденных пластов дермы тем самым предотвращая вторичное повреждение.
Динамическая оценка допплерограмм в первые сутки после ксенопластики выявила, что восстановление всех основных показателей капиллярного кровообращения к значениям близким нормальным (6,27 до 10,9 Ед.) при легком ожоговом шоке происходит уже после операции.
У пострадавших с клиникой тяжёлого ожогового шока полная ликвидация изменений в системе микроциркуляции одновременно не происходит, но гиперперфузия, которая сохраняется в ране разрешает на фоне адекватной противошоковой терапии сохранить жизнеспособность значительной массы покровных тканей до восстановления системной гемодинамики.
Из-за нарушения реакции адаптации в тяжелообожжённыхдетей младшего возраста в первые часы после травмы отмечена резкая стимуляция и дезорганизация разных звеньев регуляции нейро-эндокринной системы, о чем свидетельствует достоверное увеличение содержания в крови кортизола — в 1,5-2,9 раза, Т3 — в 1,2-1,8 раз, тогда как ТТГ и Т4 существенным образом неизменялись. В послеоперационном периоде содержание кортизола в сыворотке крови у детей достоверно постепенно снижается уже со вторых суток, а на пятые этот показательдостоверно от нормы не отличался даже в группетяжелообожжённых.
Тем самым, оперативное закрытие ран уже в периоде ожогового шока даже у тяжелообожжённых детей достоверно уменьшает проявления гиперергической реакции эндокринной системы, предупреждает истощения ее компонентов, позволяетсохранить способность ребёнка адекватно реагировать на тяжёлуюожоговую травму.
При рассмотрении наиболее общих факторов риска, которые приводят к осложнениям у детей выделяем:
- объём погибших тканей (степень и глубина ожога);
- возраст и преморбидный фон;
- наличие ожога дыхательных путей;
- локализация и этиология (для детей до 3 лет);
- продолжительность времени до поступления в больницу;
- катетеризация центральных вен.
Из пациентов с осложнениями ожоговой болезни,большинство имели неблагоприятный преморбидный фон, а из его компонентов - 71% аллергического характера. Наиболее неблагоприятной в плане развития осложнений является возрастная категория от 1 до 3 лет.
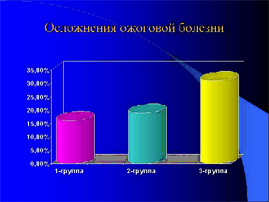
Осложнения ожоговой болезни отмечены в 15,72% (25 из 159), пятнадцать из которых имели неблагоприятный преморбидный фон. Клинические признаки пневмонии диагностированы у 8 (5,03%), анемия — у 22 (13,84%), расстройства ЦНС, в том числе судороги — у 3 (1,89%), токсический миокардит — у 2 (1,26%), осложнения со стороны ЖКТ — у 10 (6,29%) из которых в одном случае в 3 летнего мальчика — острое эрозивное кровотечение, которое удалось остановить консервативно. Во 2-группе осложнения отмечены у 18,96% обожжённых, в 3 — группе у 51 пострадавшего (31,09%) т.е. практически у трети пациентов.
В 10 случаях (6,29%)у пострадавших 1 группы развилась клиника ожогового сепсиса. По этиологии возбудителя преобладал St.aureus, а соотношение кокковой и грам-отрицательной флоры составлял 3:1. В контрольных группах сепсисом течение ожоговой болезни осложнилось у 26, из них во 2 группе у (6,7%) пострадавших, а в 3-группе у (10,4%).
Раннее оперативное лечение является решающим в профилактике ПОН.
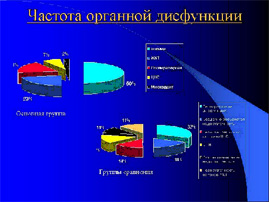
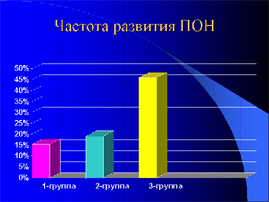
Из оперированных в шоке детей синдром ПОН отмечен у 24 (15,09%) тяжелообожжённых детей из которых превалировала одно-двух компонентная недостаточность – 19 (79,2%), и лишь у пятерых ПОН носила 3-5 компонентный характер (20,8%). Никто из оперированных детей основной группы не умер.
Во 2 и 3- группах преобладал многокомпонентный СПОН — вполовину большем числе случаев в сравнении с оперированными в шоке (54,5% и 50,9% соответственно в 2-й и 3-й группах) на фоне которого умерли во 2 группе четверо (2,98%), а в третьей – 9 пострадавших (5,49%).
Средний койко-день в 1 группе составил 10,33 против (12,44 и 18,41суток соответственно во 2-3 группах) при тяжёлых ожогах 20,93 против (23,76 и 30,89 суток соответственно в группах сравнения).
Считаем, что дермабразия — ключевой шаг для подготовки поверхности раны к её закрытию. Мы предполагаем, что, удаляя любую лишенную жизнеспособности ткань и потенциально колонизированные слои раны мы удаляем зону коагуляции в пределах зоны стаза, сокращаем прогрессивное углубление некоторых областей ожога до полной или на частичную толщину. Поэтому, мы преобразуем непредсказуемые ожоговые раны в более предсказуемые «хирургические» раны. Процедура стимулирует фибробласты, и синтез коллагена типа 1 и 3. Привнесение факторов роста в открытую рану стимулирует эпителизацию.
Констатируем, что операции в шоке являются существенным прогрессом в лечении ожогов любой этиологии у детей всех возрастных групп.
Литература
1. Лазерная допплеровская флоуметрия микроциркуляции крови / Под ред. А.И.Крупаткина, В.В.Сидорова: Руковод. для врачей. – М. «Медицина», 2005. – 256 с.
2. Почепень.О.Н., Кошельков Я.Я., Гурманчук И.Е., Петракова О.И. Алгоритм диагностики и коррекции стресс-ответа на хирургической вмешательство у больных с тяжёлой термической травмой / Сб. научн. трудов I Съезда комбустиологов России. – М., 2005. – С. 80 – 81.
3. Bang R.L., Sharma P.N., Sanyal S.C., Imad Al Najjadah Septicaemia after burn injury: a comparative study // Burns. – 2002. Vol. 28. – N 8. – P. 746-751.
4. Dugan A.L., Malarkey W.B., Schwemberger S. at al. Serum levels of prolactin, growth hormone and cortisol in burn patient // J.Burn Care Rehabil., 2004. – Vol. 25. – N 3. – P. 306 – 313.
* — глубина ожогов в статье приведена в соответствии с классификацией, принятой на Украине.
Designed by Сайт на Заказ