
ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Изучение влияния препарата «Гепа-Мерц» на функциональное состояние печени и разработка методики его применения у тяжелообожженных пациентов
Алексеев А.А.
Ушакова Т.А.
Тюрников Ю.И.
Малютина Н.Б.
Институт хирургии им. А.В. Вишневского РАМН, кафедра термических поражений, ран и раневой инфекции РМАПО, Москва
Введение
Известно, что функциональное состояние печени играет колоссальную роль в процессе формирования ответной реакции организма (адаптации) на тяжелую травму. Стрессовая перестройка метаболизма, экзо- и эндогенная интоксикация, преморбидная патология вызывают подавление функциональной активности печени.
В патогенезе гепатоцеллюлярных повреждений при термической травме ведущее значение придается системному нарушению гемодинамики, вызывающему блок печеночной циркуляции, ишемию и последующую реперфузию органа (6, 11, 12). Клинические проявления функционально-морфологической недостаточности печени в течение ожоговой болезни можно условно разделить на ранние: гепатомегалия, цитолиз, ферментемия — и поздние: внутрипеченочный холестаз, парохолия, желтуха (3, 6). Патология на клеточном уровне, по современным представлениям, реализуется посредством индукции апоптоза печеночных клеток и последующего их истощения, а также поражения непаренхиматозных клеток, запускающих цитокиновую сигнализацию усилением синтеза SOCS3 продукта и супрессией пролиферации путем снижения концентрации STAT3 протеина (8, 10).
В этой связи проводится дополнительная терапия, направленная на метаболическую поддержку органа: пептиды, эссенциале, ферменты, витамины и т.д. (1, 2, 4). Несомненный интерес может представлять препарат Гепа-Мерц, фармакологическое действие которого основано на орнитин-аспартатном комплексе, стимулирующем обезвреживание аммиака, которому в настоящее время придают большое значение в патогенезе печеночной энцефалопатии (1-5, 7, 9). Кроме того, описано его блокирующее влияние на мышечный катаболизм. В данном случае это имеет особое значение, т.к. известно, что в условиях белкового дефицита у тяжелообожженных пациентов расходуются эндогенные запасы, в первую очередь, мышечные протеины.
Материал и методы
Препарат был предоставлен компанией «Мерц» в форме для парентерального введения и приема per os. Программа исследования предусматривала комплексное лечение и обследование 26 пациентов с ожогами IIIАБ-IV степени от 20% до 80% поверхности тела и включала: общее клинико-инструментальное обследование, биохимический и клинический анализы крови, а также определение содержания аммиака в сыворотке крови глютаматдегидрогеназной реакцией с использованием реактивов фирмы «Sigma diagnostics».
У 11 тяжелообожженных пациентов Гепа-Мерц применялся внутривенно в суточной дозе 20г на 400 мл инфузионного раствора. 10 больных получали препарат перорально, причем шести из них проводился «поддерживающий» курс после внутривенной терапии. У 5 тяжелообожженных проводилось традиционное комплексное лечение, схема которого не предусматривала применение «Гепа-Мерца» (группа сравнения).
Показанием для назначения препарата Гепа-Мерц в большинстве случаев стал послеожоговый гепатит, развившийся на фоне обширных ожогов, ожоговой интоксикации, дистрофии внутренних органов с развитием полиорганной недостаточности и метаболического истощения. При обследовании больных характерными лабораторными признаками, свидетельствующими о функционально-морфологическом поражении печени были:
- Гепатомегалия (увеличение печени на 3-5см и более);
- Увеличение уровня билирубина до 53,6 мкмоль/л;
- Ферментемия (АСТ и АЛТ до 70- ед/л);
- Увеличение активности щелочной фосфатазы (ЩФ) до 700 ед/л;
- Гипопротеинемия (общий белок 45-50 г/л);
- Повышение уровня мочевины (до 10-17 ммоль/л);
- Увеличение содержания креатинина (до 200-300 мкмоль/л);
- Коагулопатия (гиперкоагуляция, ДВС-синдром).
У всех больных наблюдали сдвиг формулы крови влево до юных форм, лимфопению. Клинически отмечали гипертермию до 39С, тахиаритмию (ЧСС 100-120 в мин), одышку (ЧДД 25-30 в мин). Клинико-лабораторный контроль для оценки эффективности препарата проводили 1 раз в 2-3 дня.
Результаты и их обсуждение
Динамическое наблюдение показало, что Гепа-Мерц больные перенесли хорошо, побочных эффектов не наблюдалось. Для большинства пациентов минимальным сроком применения препарата следует считать 7 дней.
У 9 (82%) из 11 больных к 7 дню после начала использования Гепа-Мерца нормализовались основные лабораторные параметры, в том числе улучшились показатели, свидетельствующие о восстановлении функций печени (протромбиновообразовательной, синтетической, дезинтоксикационной и др.).
Вместе с тем у 2 (18%) наиболее тяжелых пациентов, у которых течение ожоговой болезни осложнилось развитием сепсиса по клинико-лабораторным данным функциональное восстановление печени «задерживалось», что послужило основанием для продолжения внутривенного курса лечения до 12-13 суток. Кроме того, с учетом тяжести состояния больных с целью профилактики возможных дальнейших осложнений со стороны печени, связанных как с массивным медикаментозным воздействием, так и с продолжающейся до восстановления целостности кожных покровов ожоговой болезнью, применение Гепа-Мерца у 6 пациентов продолжалось в пероральной форме еще в течение 14 дней.
На этом фоне нами не было отмечено проявлений функциональной недостаточности печени, а нутритивные показатели (общий белок, альбумин, общий гемоглобин, лимфоциты и др.) имели тенденцию к дальнейшему улучшению или стабилизации.
Еще в 4-х случаях у больных с глубокими, но ограниченными по площади ожогами до 10% поверхности тела Гепа-Мерц был назначен в пероральной форме в связи с развившимся алкогольно-интоксикационным делирием или угрозой его развития (у пациентов, страдающих хроническим алкоголизмом). В этих случаях Гепа-Мерц был включен в схему проводимой дезинтоксиционной и седативной терапии, что позволило уменьшить проявления делирия и его продолжительность, нормализовать функциональные печеночные пробы уже на 7 сутки после начала лечения.
Гепа-Мерц, фармакологическое действие которого основано на орнитин-аспартатном комплексе, стимулирует обезвреживание аммиака. Кроме того, описано его блокирующее влияние на мышечный катаболизм. Как известно, в условиях белкового дефицита у тяжелообожженных пациентов расходуются эндогенные запасы, в первую очередь, мышечные протеины.
В рамках комплексного обследования проведено более 50 определений содержания аммиака в сыворотке крови у тяжелообожженных пациентов в течение острого периода. В итоге — исходно и в динамике отмечены колебания значения показателя в пределах нормы (0.20-0.80 миллиграмм/мл). У данной категории больных этот показатель оказался не патогномичным тяжести состояния, т.к. всем больным проводилась интенсивная терапия. Вместе с тем, считаем целесообразным продолжить данные исследования у больных, находящихся в делириозном состоянии, а также провести детальное исследование азотистого баланса по азоту мочевины и аминокислот в условиях лечения гепа-мерцем.
Накопление конечных продуктов белкового метаболизма — известный критерий полиорганной недостаточности, а также гиперкатаболизма и повышенного экзогенного введения АК. В группе внутривенного применения гепа-мерца четко прослеживается снижение уровня мочевины после проведенного курса, в то время, как в группе сравнения наблюдается продолжающееся накопление этого метаболита (рис. 2). Даже больной с «плохим» прогнозом (б-й У. рис. 1) откликнулся на вводимый препарат уменьшением содержания мочевины в наблюдаемый период. У пострадавших, в состав комплексной терапии которых не входил гепа-мерц, положительная динамика на фоне интенсивного лечения была отсрочена и наблюдалась через продолжительное время.
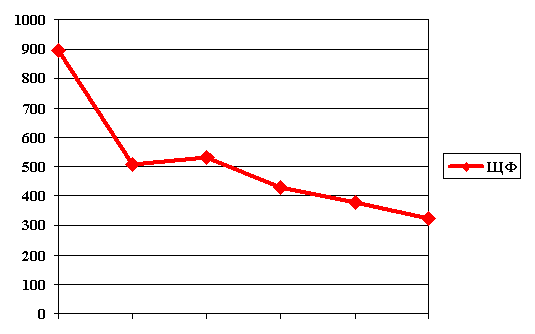
Рис. 1. Динамика уровня мочевины (ммоль/л) у тяжелообожженных на фоне применения препарата ГепаМерц (в/в курс)
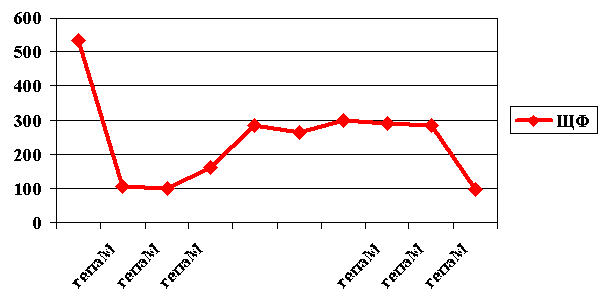
Рис. 2. Динамика уровня мочевины (ммоль/л) у тяжелообожженных при традиционном лечении (группа сравнения)
Необходимо отметить, что у части пациентов наблюдается однократное незначительное повышение уровня мочевины сразу после введения препарата. По-видимому, сказывается дополнительное введение субстрата для синтеза мочевины в виде орнитин-аспартатного комплекса. Этот факт необходимо учитывать, по нашему мнению, при решении о назначении препарата в более высоких дозах.
Как уже указывалось, у тяжелообожженных пациентов функциональная недостаточность печени полиэтилогична. Одним из ее проявлений является повышение активности щелочной фосфатазы (ЩФ). Мы проследили и сравнили динамику этого показателя в разных группах (табл.1).
В результате применения данного препарата происходит уменьшение застойных явлений в печени в короткие сроки. Напротив, в группе сравнения наблюдается персистирующее повышение активности ЩФ длительное время (до месяца).
|
Табл. 1 |
|||
|
лечение Гепа-Мерц |
традиционное лечение |
||
| до лечения | через 7 сут | до лечения | через 7 сут |
| 790.6 | 413.0 | 495.0 | 472.0 |
| 584.2 | 243.0 | 296.1 | 250.0 |
| 534.0 | 253.0 | 354.0 | 472.0 |
| 300.0 | 76.0 | 377.6 | 374.6 |
| 495.6 | 103.2 | 354.0 | 539.0 |
| 354.0 | 183.0 | ||
| 438.9 | 198.2 | ||
| 236.0 | 136.8 | ||
| Сред. знач. 466.6 | Сред. знач. 200.8 | Сред. знач. 375.0 | Сред.знач. 421.5 |
Необходимо отметить, что у 3 больных отмечалось однократное повышение активности фермента сразу после введения лекарства, что вполне объяснимо: на фоне выраженных нарушений микроциркуляции, повышения мембранной проницаемости и внутриклеточной гидратации любая метаболическая стимуляция может вызывать дополнительное напряжение указанных процессов. Этот факт необходимо иметь ввиду у тяжелообожженных пациентов в острый период и для достижения желаемого эффекта предпочесть более длительный курс увеличению суточной дозы.
Одним из проявлений функциональной недостаточности печени является билирубинемия, которая довольно часто наблюдается у тяжелообожженных пациентов в острый период. Также повышение уровня билирубина отмечается у больных, ранее перенесших вирусную инфекцию. По нашим данным гепа-мерц оказывает влияние на этот показатель (табл.2).
|
Табл. 2 |
|
|
До лечения |
после лечения |
| 17.5 | 9.6 |
| 53.3 | 47.5 |
| 33.0 | 7.9 |
| 18.5 | 10.5 |
| 53.6 | 12.9 |
| 16.5 | 12.0 |
| Сред.знач. 32.1 | Сред.знач. 20.0 |
Клинико-лабораторную эффективность препарата хорошо иллюстрируют следующие два примера.
Больной К. с диагнозом: ожоги пламенем II-IIIАБ-IV ст. 30% п.т., термоингаляционная травма, сепсис, желудочно-кишечное кровотечение. Гепа-Мерц назначен во внутривенной форме на фоне тяжелого течения ожоговой болезни, осложненной ранним сепсисом, подтвержденным положительными посевами крови, развитием полиорганной недостаточности. Биохимические показатели отражали выраженную функциональную печеночную недостаточность. Проведен 7-дневный курс в суточной дозе 20г на 400 мл инфузионного раствора с выраженным эффектом по клинико-лабораторным данным (рис. 3).

Рис 3. Динамика активности щелочной фосфатазы у больного К. (внутривенный курс гепа-мерца в теч 7 сут)
Больной А., 16 лет, и/б 171 поступил в отделение через 6 мес после получения ожогов III-IV ст. 50% п.т., осложнившихся ожоговым сепсисом и истощением. Комплексная интенсивная терапия позволила достигнуть относительной стабилизации его состояния. Однако, сохранялись застойные явления в билиарной системе, сопровождающиеся упорным повышением активности щелочной фосфатазы. Назначен гепа-мерц внутривенно в дозе 10г на 200мл раствора в теч 7 сут, продолженный пероральным курсом в течение последующих 7 сут. Показатели нормализовались. Через 3 недели после отмены гепа-мерца вновь повысилась активность ЩФ. Назначен третий курс препарата в пероральной форме, по окончании которого получен стойкий положительный эффект (рис. 4).

Рис 4. Динамика активности щелочной фосфатазы у больного А. (3 курса гепа-мерца)
Заключение
Таким образом, анализ результатов проведенного исследования показал эффективность применения препарата Гепа-Мерц в комплексном лечении тяжелообожженных. Применение препарата Гепа-Мерц позволяет усилить направленное лечебное воздействие на функционально-морфологическое состояние печени и показано для профилактики и лечения послеожоговых интоксикационных гепатитов. При этом Гепа-Мерц следует назначать парентерально в максимальной суточной дозе 20 г на 400 мл физиологического раствора. Курс лечения определяется индивидуально и колеблется от 7 дней до 3 недель. Возможно последовательное назначение препарата в разных формах (внутривенное введение, применение Гепа-Мерц per os).
Список литературы
- Ивашкин В.Т., Надинская М.Ю., Буеверов А.О. //Печеночная энцефалопатия и методы ее метаболической коррекции// Росс. мед. жур., 2001, т.3, N1.
- Маев И.В., Вьючнова Е.С., Лебедева Е.Г., Яковенко Е.И., Дичева Д.Т.//Оценка эффективности комплексной терапии печеночной энцефалопатии у больных циррозом печени// Клин. мед., 2002, 5.
- Надинская М.Ю. //Печеночная энцефалопатия// Росс. Журнал гастроэнтерологии, гепатологии, колопроктоогии, 1998; 2:25-32.
- Подымова С.Д. //Печеночная энцефалопатия. Клинические особенности, диагностика, лечение// Интернет: http://www/nedug.ru/lib/lit/therap/01oct/therap153/therap.htm.
- Bukowska W, Szarzewski A, Szumera M, Raczkowska-Kozak J, Korzon M //Acute hepatic insufficiency acute liver failure in five children// Med Sci Monit, 1998, 4.
- Czaja AJ, Rizzo TA, Smith WR Jr, Pruitt BA Jr //Acute liver disease after cutaneous thermal injury// J Trauma. 1975 Oct;15(10):887-94.
- Feher J, Lang I, Gogl A, Varga L, Tompos G, Pronai L //Effect of ornithine-aspartate infusion on elevated serum ammonia concentration in cirrhotic patients — results of a randomized, placebo-controlled double-blind multicentre trial// Med Sci Monit, 1997; 3(5).
- Jeshke MG, Low JF, Spies M, Vita R, Hawkins HK, Herndon DN, Barrow RE// Cell proliferation, apoptosis, NF-kappaB expression, enzyme, protein, and weigt changes in livers of burned rats// Am J Physiol Gastrointest Liver Physiol. 2001 Jun;280(6):G1314-20.
- Kaiser S, Gerok W, Haussinger D //Ammonia and glutamine metabolism in human liver slices: new aspects in the pathogenesis of hyperammoniemia in chronic liver diseases// Eur. J. Clin. Invest. 1988; 18:535-42.
- Kong F, Guo X, Noel JG, Wells DA, Lovell GJ, Ogle CK //Thermal injury-induced increases of hepatocyte SOCS3 lead to decreases in STAT3// Shock. 2002 Oct;18(4):374-9.
- Tadros T, Traber DL, Herndon DN //Hepatic blood flow and oxygen consumption after burn and sepsis// J Trauma. 2000 Jul;49(1):101-8.
- Tadros T, Traber DL, Herndon DN //Trauma- and sepsis- induced hepatic ischemia and reperfusion injury: role of angiotensin II/ Arch Surg. 2000 Jul;135(7):766-72.
Designed by Сайт на Заказ