ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Клинико-морфологическая оценка результатов комбинированной ауто-дермопластики с трансплантацией культивированных фибробластов у обожженных
Матчин Е.Н.
Потапов В.Л.
Алексеев А.А.
Областная больница, г.Тула , Институт хирургии им. А.В. Вишневского РАМН, г.Москва.
Одной из основных задач при лечении тяжелообожженных является скорейшее и эффективное восстановление кожного покрова одновременно на большой поверхности тела. До недавнего времени для этого предлагалось использовать сетчатые ауто-трансплантаты с большим коэффициентом растяжения (1:6, 1:8 и более), на фоне мощной инфузионно-трансфузионной терапии и необходимого медикаментозного лечения с обязательным применением антибиотиков (Вихриев Б.С. 1986г.). Однако при пластике сетчатыми трансплантатами с большим коэффициентом растяжения, через широкие ячейки в сетке до их эпителизации происходит дальнейшая потеря белка, электролитов, и энергии, возможно и инфицирование ран. Длительное нарушение гомеостаза, прогрессируя часто вызывает такие грозные осложнения как: сепсис и пневмония, развиваются почечная и печеночная недостаточность. Основной же причиной этих осложнений является длительное существование обширных ожоговых ран на фоне дефицита неповрежденной кожи, а также медленная эпителизация ячеек в сетчатом аутотрансплантате с широкой перфорацией. Для устранения указанных недостатков мы, как и многие другие авторы, пытались внедрить комбинированную пластику прикрывая сетчатый аутотрансплантат ксено-, алло-, гетерокожей, амниотической оболочкой, тканевым имитатором кожи (Матчин Е.Н. 1975г., Kiene S. et al. 1976г., Levin N.S. et al. 1976г., Harris N.L. et al. 1976г., Berry R.B. et al. 1980г., Salisbury R.E. et al. 1980г.), однако при подобной комбинации вомногом ухудшался отток раневого отделяемого, что нередко приводило к отслойке и расплавлению сетчатого трансплантата.
С учётом невозможности использования донорской кожи в 70-80 годы, во всем мире начались работы по культивированию клеток кожи in vitro с целью последующей их трансплантацией на рану (H.J. Igel и A.E. Freeman 1974г., Fukui J. 1976г., Nathan P. et al. 1978г., Волкова Н.А. 1981г., Davies J.W.L. 1983г., Brychta P. et al. 1994г.).
В 1981 году O’Connor et al. была выполнена первая успешная трансплантация культивированных кератиноцитов на рану двум обожженным. Несмотря на перспективность метода при лечении больных с тяжелыми ожогами, его трудоёмкость, высокая стоимость, длительные сроки получения эпидермальных лоскутов не позволяют внедрить данный метод в широкую клиническую практику для лечения всех пострадавших, кто в нём нуждается.
Кроме этого было выявлено, что в ряде случаев наблюдается нестойкость эпителиального покрова и любое, даже минимальное механическое воздействие может вызывать его повреждение (Loring W. et al. 1993г.). В настоящее время с целью преодоления этих недостатков при использовании клеточной культуры кератиноцитов предложены варианты комбинированной пластики с применением или гомокожи, или аутотрансплантатов с коэффициентом перфорации 1:9.
В отделении патологической анатомии и центре термических поражений института хирургии им. А.В. Вишневского РАМН (Саркисов Д.С. с соавт. 1991г., Алексеев А. А. с соавт.1995г.) уже несколько лет подробно изучались процессы протекающие в ранах. Разработанно принципиально новое направление хирургического лечения обширных ожоговых ран на основе применения культивированных аллофибробластов. При обширных глубоких ожогах предложена методика комбинированной аутодермопластики с трансплантацией культивированных аллофибробластов. В Тульской областной больнице разработанный в Институте хирургии им.А.В.Вишневского метод лечения обожженных применяется с 1994 года.
Основу нашего исследования составили результаты обследования и лечения 16 обожженных (Таблица 1.), из которых было 3-е детей до шестилетнего возраста, одна больная в возрасте свыше 60 лет, а основную группу из 12 больных, составили лица от 20 до 57 лет. Общая площадь термического поражения колебалась от 10 до 45% поверхности тела. Площадь глубокого ожога IIIB степени до 10% поверхности тела была у 1-го больного, от 10 до 20% поверхности тела у 7 больных и свыше 20% — у 6-ти больных. У 2-х больных были обширные, на площади до 30% поверхности тела, пограничные ожоги III-а степени.
Контрольную группу составили 15 больных с идентичными по тяжести и площади ожогами.
|
Таблица 1. |
|||||
|
Возраст |
Количество больных |
Общее число |
|||
| III-A | III-Б | ||||
| свыше 30% | 10% | 10-20% | свыше 20% | ||
| До 6 лет | 1 (1) | 1 (1) | 1 | 3 (2) | |
| 20-57 лет | 2 (2) | (1) | 5 (7) | 5 (2) | 12 (12) |
| Свыше 60 лет | 1 (1) | 1 (1) | |||
| Общее число | 2 (2) | 1 (1) | 7 (7) | 6 (2) | 16 (15) |
Примечание: В скобках дана контрольная группа.
Трансплантаты культивированных аллофибробластов готовили в лаборатории института, доставляли в Тульскую областную больницу, где в тот же день производилась трансплантация культивированных клеток на подготовленные гранулирующие раны.Через 2 дня проводился второй этап операции — пластика ожоговых ран сетчатыми аутотрансплантатами с коэффициентом пластики 1:4 у детей или 1:6 у взрослых.
Эффективность лечения оценивали в динамике, клинически, по результатам гистологического исследования биопсийного материала и другого комплексного лабораторного изучения.
При ожогах III-а степени полная эпителизация ран заканчивалась на 8 сутки после пересадки клеточной культуры фибробластов.
При глубоких ожогах, в группе с пересадкой фибробластов, эпителизация в ячейках трансплантата с коэффициентом пластики 1:6 начинается на вторые сутки. Перемычки сетчатого трансплантата погружались в грануляционную ткань раны покрытую фибробластами, при этом увеличивалась площадь плазматического питания за счет боковых пластин, в то время как, без пересадки фибробластов на вторые сутки перемычки возвышались над грануляционной тканью, а погружение происходило на 4-7 сутки.
На 8-е сутки пограничные ожоги в основном эпителизировались полностью, а площадь ячеек сетчатого трансплантата эпителизировалась на 50%.
На 10-е сутки определялась практически полная эпителизация в группе с пересадкой фибробластов, в то время как в контрольной группе определялась лишь краевая эпителизация, при этом от 30 до 50% пересаженных лоскутов лизировалось.
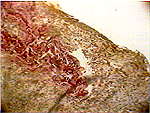
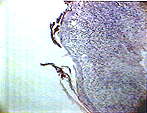
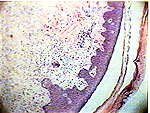
При гистологическом исследовании в группе больных с использованием фибробластов наблюдалось качественное отличие вновь образовавшегося эпителия в сравнении с контролем: на 3-и сутки в препаратах наблюдалась молодая грануляционная ткань с обильной лимфолейкоцитарной инфильтрацией и единичными тучными клетками, поверхность грануляций покрывали пролиферирующие фибробласты (рис.1), на 5-е сутки в ростковой зоне рядом с аутолоскутом наблюдался 3-х слойный эпителий с нечеткой дифференцировкой слоев (рис.2) в подлежащих тканях очаговый отек, обильная лимфоплазмоцитарная инфильтрация с примесью лейкоцитов, небольшое количество вновь образованных капилляров, а уже к одиннадцатым суткам отмечалась четкая дифференцировка эпидермиса на слои, появлялись акантотические тяжи, дифференцировка дермы была еще не четкой, но уже начинал определяться сосочковый слой, а на месте сетчатого слоя наблюдалась пролиферация фибробластов (Рис. 3).
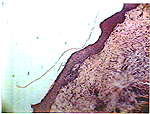
В группе без пересадки фибробластов даже на 20 сутки после аутопластики определялся истонченный эпидермис без акантотических тяжей и дифференцировки на слои, с обильной лимфолейкоцитарной инфильтрацией дермы (Рис. 4).
Активизация эпителизации под действием культуры фибробластов приводила не только к клиническому улучшению, но и к сдвигам, по сравнению с контролем, показателей гуморального и клеточного иммунитета.
Уровень гуморального и клеточного иммунитета в динамике представлены в таблице 2.
|
Таблица 2. |
|||||
|
Показатели |
До операции |
2-6 сутки после операции |
7-15 сутки после операции |
||
| с пересадкой культуры | без пересадки культуры | с пересадкой культуры | без пересадки культуры | ||
| I | II | III | IV | V | |
| Лимфоциты в% | 19,5+2,06 | 21,5+0,20 | 28,0+2,00 | 34,0+2,03 | 21,5+1,02 |
| Лимфоциты в тыс. | 1,8330+0,180 | 1,4450+0,096 | 1,7070+0,087 | 1,8520+0,109 | 1,6435+0,112 |
| Фагоцитоз в % | 62,5+4,59 | 61,0+2,86 | 71,5+3,50 | 75,0+3,95 | 73,5+1,84 |
| ЦИК в % | 88,5+2,37 | 93,5+0,61 | 83,0+1,00 | 92,0+1,08 | 89,5+1,02 |
| Активность комп. в ед. | 88,5+3,64 | 85,5+0,20 | 87,0+4,89 | 83,0+2,59 | 67,0+4,08 |
| Т-лимфоциты в % | 67,5+1,42 | 63,5+1,84 | 54,0+1,95 | 55,0+1,38 | 62,0+0,82 |
| Т-лимфоциты в тыс. | 1,2105+0,098 | 0,9265+0,089 | 0,9205+0,029 | 0,9910+0,096 | 1,0240+0,083 |
| Т-активные лимфоци-ты в % | 33,5+0,47 | 35,0+0,41 | 27,5+2,50 | 21,0+1,57 | 32,5+1,43 |
| Т-активные лимфоци-ты в тыс. | 0,4100+0,0390 | 0,3215+0,0270 | 0,2520+0,0150 | 0,2080+0,0810 | 0,3255+0,0125 |
| В-лимфоциты в % | 21,0+1,26 | 27,0+1,22 | 16,5+0,50 | 19,0+1,09 | 14,0+0,82 |
| В-лимфоциты в тыс. | 0,4080+0,062 | 0,3830+0,008 | 0,2810+0,006 | 0,3420+0,098 | 0,2355+0,029 |
| О-лимфоциты в % | 11,5+0,16 | 5,5+2,25 | 29,5+1,50 | 26,0+1,64 | 24,0+1,63 |
| О-лимфоциты в тыс. | 0,2145+0,0240 | 0,0680+0,0280 | 0,5055+0,0510 | 0,4690+0,0770 | 0,3840+0,0051 |
| Иммуноглобулины: А | 252,5+8,69 | 234,0+10,61 | 150,0+15,00 | 220,0+17,87 | 297,5+1,02 |
| Иммуноглобулины: G | 1200+31,62 | 1400+91,86 | 1400+250,00 | 1250+67,07 | 2085+169,42 |
| Иммуноглобулины: М | 97,5+13,44 | 95,0+12,25 | 90,0+20,29 | 170,0+27,06 | 65,5+0,20 |
| Тн (с теофилином) | 50,0+5,06 | 45,0+5,31 | 36,0+3,00 | 31,0+4,04 | 40,5+1,84 |
| Тс (с теофилином) | 17,5+3,64 | 18,5+3,47 | 18,0+2,00 | 24,0+3,01 | 21,5+1,02 |
Примечание: Достоверность разницы между вариационными рядами см. по тексту.
На показатели иммунитета влияют множество факторов (Лебедев К.А. с соавт. 1990г., Долгушин И.И. с соавт. 1989г.), которые зачастую не зависят от проводимой терапии, поэтому делать окончательные выводы на нашем относительно ограниченном материале нельзя, но общие тенденции проследить можно: Как видно из таблицы влияние операции на показатели гумморального иммунитета до 6 суток было минимальным и связанно, по нашему мнению, с общим стабилизирующим воздействием на внутреннюю среду организма удачной пересадки аутокожи на большой площади.
Влияние на клеточный иммунитет было более выраженным. В группе больных с использованием культуры фибробластов на 2-6 сутки после аутопластики происходило, в сравнении с контрольной группой больных, достоверное (Р ?0,05)уменьшение процентного содержания и абсолютного числа лимфоцитов, увеличение процентного содержания и абсолютного числа Т-активных лимфоцитов и В-лимфоцитов, резкое снижение процентного содержания и абсолютного числа нулевых лимфоцитов (табл. №2).
На 7-15 сутки после аутопластики динамика изменений иммуноглобулинов была более показательна, и если в группе без фибробластов наблюдалось повышение иммуноглобулинов А и G, что коррелировало с воспалительной реакцией при лизисе части лоскутов, то в группе с пересадкой фибробластов наблюдалось повышение иммуноглобулинов М, что связанно, по нашему мнению, с реакцией антигенантитело.
Клеточный иммунитет в группе с пересадкой фибробластов в основном нормализовывался, но вызывает удивление, практически одинаковое повышение на 7-15 сутки, в обеих группах, О-лимфоцитов как в процентном отношении, так и в абсолютных цифрах.
Особенно сильное влияние комбинированная пластика оказывала на тест эндогенной интоксикации (Таблица 3).
Как видно по таблице уже на 5-10 сутки снижалось содержание ВСНММ в плазме и на эритроцитах, резко почти в 2 раза по сравнению с контрольной группой снижалось содержание олигопептидов в плазме. На эритроцитах в контрольной группе содержание олигопептидов снижалось еще больше, что и определяло низкий, более чем в 3 раза ниже чем в контрольной группе индекс токсемии в плазме и практически одинаковый индекс токсемии на эритроцитах. Индекс интоксикации, в контрольной группе оставался на уровне дооперационного, а в группе с пересадкой фибробластов более чем на 10 условных единиц ниже. Это определяло более высокую эффективную концентрацию альбумина и увеличивало связывающую способность плазмы.
|
Таблица 3. |
||||||
|
Показатели |
До операции |
5-10 сутки после аутопластики |
Достоверность |
|||
| с пересадкой культуры | без пересадки культуры | P1 | P2 | P3 | ||
| I | II | III | ||||
| ВНСММ в плазме (усл.ед.) | 13,6+0,5 | 10,17+0,22 | 16,92+0,48 | <0,05 | <0,05 | <0,05 |
| ВНСММ на эритроцитах (усл.ед.) | 35,28+0,13 | 31,71+0,17 | 28,31+0,11 | <0,05 | <0,01 | <0,05 |
| олигопепт. в плазме (усл.ед.) | 0,92+0,12 | 0,78+0,09 | 1,35+0,3 | <0,05 | <0,01 | <0,01 |
| олигопепт. на эритроц. (усл.ед.) | 0,97+0,07 | 0,9+0,04 | 0,74+0,06 | >0,05 | >0,05 | >0,05 |
| инд. токсем. в плазме (усл.ед.) | 16,3+0,89 | 7,99+1,06 | 25,38+1,52 | <0,05 | <0,01 | <0,01 |
| инд. токсем. в эритроц. (усл.ед.) | 33,08+0,3 | 28,11+0,17 | 23,94+0,9 | <0,05 | <0,05 | <0,05 |
| индекс интоксикации (усл.ед.) | 49,39+1,24 | 36,1+1,24 | 49,31+2,41 | <0,05 | >0,05 | <0,05 |
| ЭКА (г/л) | 19,5+0,4 | 23,5+0,61 | 22,5+0,5 | <0,05 | <0,05 | >0,05 |
| ССП (%) | 29,5+0,08 | 36+0,82 | 34,5+0,8 | <0,05 | <0,05 | >0,05 |
Примечание:
- P1 — достоверность разницы между I и II группами.
- P2 — достоверность разницы между I и III группами.
- P3 — достоверность разницы между II и III группами.
Кроме этого в группе с пересадкой фибробластов на 2-5 сутки происходила стабилизация лейкоцитарного индекса интоксикации на низких цифрах, а в контрольной группе он оставался высоким и к 10-м суткам был выше исходного почти в три раза (Таблица 4).
|
Таблица 4. |
|||||||||
|
Исходные |
На 2-5 сутки после аутопластики |
На 6-12 сутки после аутопластики |
|||||||
| I | II | III | IV | V | |||||
| Основная группа | Контрольная группа | Основная группа | Контрольная группа | ||||||
| L | ЛИИ | L | ЛИИ | L | ЛИИ | L | ЛИИ | L | ЛИИ |
| 9,55+0,03 | 3,47+0,16 | 5,25+0,03 | 0,43+0,02 | 5,95+0,03 | 5,28+0,51 | 5,35+0,22 | 0,39+0,05 | 10,05+1,28 | 7,34+1,91 |
Примечание:
- L — Лейкоциты в тыс.
- ЛИИ — Лейкоцитарный индекс интоксикации, рассчитанный по формуле Кальф-Калифа.
- P1 — разница между I и II группами: <0,01.
- P2 — разница между I и III группами: <0,01.
- P3 — разница между II и III группами: >0,05.
- P4 — разница между I и IV группами: <0,05.
- P5 — разница между I и V группами: >0,05.
- P6- разница между IVи V группами: <0,01.
Комбинированная пластика с использованием фибробластов во всех наблюдениях исключала развитие аллергических реакций, благодаря снижению антигенных свойств клеточной культуры при многократных пассажах во время выращивания, ускоряла репаративные процессы в ране и краевую эпителизацию в сетчатом трансплантате, уменьшала боли при перевязках. Снижался расход трансфузионных сред, чем удешевлялось лечение тяжелообожженных. Кожный покров, восстановленный сетчатыми аутотрансплантатами с использованием культивированных фибробластов, в отдаленные сроки в значительной степени утрачивал сетчатый рисунок и косметически выглядел намного лучше, чем кожный покров, восстановленный сетчатыми трансплантатами в чистом виде.
Обуславливая быструю эпителизацию ожоговых ран даже при критических ожогах; комбинированная аутодермопластика с трансплантацией культивированных аллофибробластов исключала в наших наблюдениях развитие опасных для жизни осложнений ожоговой болезни. Сроки стационарного лечения для группы больных с использованием клеточной культуры фибробластов составили 54,6+3,2 дня, для контрольной группы 87,4+6,7, при этом снизилось число оперативных вмешательств на каждого больного и составило для больных с использованием клеточной культуры фибробластов 1,8 в контрольной 2,6.
Метод восстановления кожного покрова с использованием фибробластов улучшал функциональные и косметические результаты лечения. Методическая простота, умеренная цена, безопасность транспортировки на большие расстояния, дает широкие возможности для широкого внедрения метода в практическое здравоохранение страны.
Выводы
- При комбинированной аутодермопластике с трансплантацией культивированных аллофибробластов эпителизация в ячейках сетчатого трансплантата начиналась на 2-е сутки опережая по времени эпителизацию при традиционной кожной пластике. Стимулируя регенеративные процессы в гранулирующей ране, клеточная культура фибробластов способствовала более быстрому «погружению» перемычек сетчатого трансплантата в грануляционную ткань, тем самым увеличивая площадь плазматического питания, за счет боковых насечек и способствуя лучшему приживлению кожного трансплантата.
- Гисто-морфологические исследования показалия, что при комбинированной пластике с использованием культуры фибробластов уже на 5-е сутки начиналось, а на 11-е сутки четко определялась дифференцировка эпидермиса на слои и начиналась дифференцировка дермы. В контрольной группе больных подобная дифференцировка не определялась даже к концу третьей недели.
- Как показали иммунологические исследования, обладая сниженными антигенными свойствами, клеточная культура фибробластов не вызывает сенсебилизирующего эффекта, а положительный иммуномодулирующий эффект ее объясняется высокими регенеративными способностями, обеспечивающими более быструю эпителизацию ожоговых ран в сравнении с контрольной группой.
- При использовании комбинированной пластики с использованием культуры фибробластов степень эндогенной интоксикации (ВНСММ и олигопептиды в плазме, индекс токсемии в плазме и общий индекс интоксикации) уже на 5-10 сутки была после операции достоверно ниже чем в контрольной группе больных.
- Метод восстановления кожного покрова с использованием культивированных аллофибробластов, обуславливая быструю эпителизацию ожоговых ран сокращает сро-ки пребывания в стационаре, улучшает функциональные и косметические результаты пластики.
Библиография
- Bohmert H. et al. Hautersatz bei Verbrennungen mit Spalhautnetztrransplantaten und Xenotranspiantaten. B.; Heidelberg; N. Y. 1974. 94 S.
- Вихриев Б.С. Перспективы дальнейшего улучшения помощи обожженным. — Вестник хирургии, — 1986, — №5. — с. 89-91.
- Матчин Е.Н. Активная хирургическая тактика при лечении глубоких ожогов в условиях Донской городской больницы Тульской области: Автореф. дис. … канд. мед. наук. Рязань, 1975. 17с.
- Billingham R.E.,Medawar P. Technique of free skin grafting in mammals. — J. Exp. Bio., — 1950, — N 28, — p. 385-402.
- Karasek M., In vitro culture of human skin epithelial cell. — J. Invest. Dermatol., 1966., — ?47, — p. 533-540.
- Igel H.J., Freeman A. E., Boeckman C. K., Kleinfeld K. L. A new method for cjvering large surface area wounds with autografts. II. Surgical application of tissue culture extended rabbit-skin autografts. Arch. Surg., — 1974, — vol. 108, — ?5. — p. 724-729.
- Freeman A. E., Igel H. J., Waldman N. L., Lisicoff A. M. A new method for covering large area wounds with autografts I in vitro multiplication of rabbit-skin epithelial cells. Arch. Surg., — 1974, — vol. 108, — ?5. — p. 721-723.
- Kiene S., Schill H., Rower J., Frick U. Lyophilisierte Schweinespalthant als biologischer Wundverband, — Zbl. Chir. — 1976, — Bd 101, — №24. — s. 1481-1494.
- Levin N.S., Lindberg R.A., Salisbury R.A., Mason A.D., Pruitt B.A. Comparison of coarse mesh ganze with biological dressings on granulating wonnds. — Am. J. Surg., — 1976, — 131 — 6. — s. 727-729.
- Harris N.S., Compton J.B., Abstan S., Larson D.L. Comparison of Fresh, Frozen and Lyophilized Poreine Skin as Xenografts on Burned Patients. — Burns — 1976, — 2 — №2. — s. 71-75.
- Berry R.B. Hackett M.E.J. A comparative evalnation of lyophilized homograft. Lyophilized pigskin and frozen pigskin biological dressings. — Burns. — 1980, — 7 — №2. — s. 84-89.
- Salisbury R.E., Carnes R.W., Enterline D. Biological dressings and evaporative water loss from burn wonnds. — Ann. plast. surg. — 1980, — 5 — №4 — s. 270-272.
- Fukui J. Dermal contend of epidermal differentiation in vitro. J. Sci. Univ. Tokyo, — 1976, — Sec, vol. 4, — 13, — ?4. — p. 353-361.
- Nathan P., Robb E. C., Harper A. D., Ballantyne D. L. Long-tern skin preservation by combined use of tissue culture and freezing techniques. Cryobiology, — 1978, — vol. 15, — ?2. — p 133-141.
- Волкова Н.А. Органное культивирование кожи и его применение в трансплантоло-гии. — Криобиология и криомедицина,- 1981,- №9. — с. 77-83.
- Davies J.W.L. Synthetic materials for covering burn wounds: Progresstowards perfection. Part II. Longer term substitutes for skin. Burns, — 1983 — vol. 10 — ?2. — p. 104-108.
- Brychta P., Adler J., Rihova H., Suchanek I., Komarkova J. Cultured skin cells for treatment of burns. — Ann. Medit. Burns Club — 1994, — vol. VII — ?.4, — р. 206-208.
- O’Connor N. E., Mulliken J. B., Banks-Schlegel S., Kehinde O., Green H. Grafting of burns with cultured epithelium prepared from autologous epidermal cells. Lancet, — 1981, — ?1. — p. 75-78.
- Loring W. Rue, III, MD, William G. Cioffi, MD, William F. McManus, MD, and Basil A. Pruitt, Jr, MD. Wound closure and outcome in extensively burned patients treated with cultured autologous keratinocytes. — The Journal of Trauma. — 1993, Vol. 34, No. 5 — p. 662-668.
- Ж.-М.Рив (Франция) // Доклад на международном симпозиуме, -Тула- 1996г.
- Саркисов Д.С. с соавт. Аллотрансплантация культивированных фибробластов на незаживающие раны после аутодермопластики. — Бюллетень эксериментальной био-логии и медицины. — 1991, — №5. — с.77-81.
- Применение культуры фибробластов для лечения тяжелообожжонных // Вест-ник новых медицинских технологий, Тула 1995 Т. II, №1-2 — С. 96-99 [соавт. А. А. Алексеев, Е. В. Глущенко, Е.Н. Матчин, В. А. Огольцова]
- Малахова М.А. Метод регистрации эндогенной интоксикации. — Пособие для вра-чей. — Санкт-Петербург, — Издательство С.-Петербургской медицинской академии после дипломного образования. — 1995, — 34 с.
- Миллер Ю.И., Добрецов Г.Е. Определение эффективной концентрации альбумина в крови. — Флуоресцентные методы исследования и клинической диагностики (сбор-ник). — Рига, — 1991, — с. 5-18.
- Кальф-Калиф Я.Я. О лейкоцитарном индексе интоксикации и его практическом зна-чении. // Врачебное дело. — 1941. -№1. — С.31-35.
- Лебедев К.А., Понякина И.Д. — Иммунограмма в клинической практике. — М. — Нау-ка — 1990, — 224с.
- Долгушин И.И. с соавторами, — Иммунология травмы. — Свердловск. — Уральский университет. — 1989, — 20с.