
ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
МАРКЕРЫ ВОСПАЛЕНИЯ В ДИАГНОСТИКЕ ОЖОГОВОГО СЕПСИСА
Ушакова Т.А., Алексеев А.А., Крутиков М.Г., Бобровников А.Э.
ФГБУ «Институт хирургии им. А.В. Вишневского» МЗ России, г. Москва
Кафедра термических поражений, ран и раневых инфекций ГБОУ ДПО РМАПО
г. Москва
Актуальность. Основной целью адаптации при тяжелой ожоговой травме является восстановление нарушенного гомеостаза и утраченного кожного покрова. Эти глобальные задачи организм решает путем запуска универсальной воспалительной реакции, которая является генетически запрограммированным способом элиминации чужеродных антигенов. Поэтому воспаление должно продолжаться до тех пор, пока организм не устранит измененные собственные антигены (источник – погибшие клетки) или микробные (источник – инвазия экзо- и эндогенного характера).
С другой стороны, известно, что системное воспаление само оказывает негативное воздействие на организм. Поэтому, основной задачей клинициста является устранение нежелательных эффектов воспалительной реакции, сохранив при этом его оптимальный уровень для восстановления собственного гомеостаза.
На основании результатов ранее проведенных исследований (1) нами было показано, что для достижения срочной адаптации и благоприятного течения ожоговой болезни необходима умеренно выраженная (2-3 средних нормы) воспалительная реакция, проявляющаяся стрессовым фоном, гиперметаболизмом, фагоцитозом, первичным адаптивным иммунным ответом (Th1), последовательно сменяющимся на вторичный (Th2). На практике регулярно выполнять подобный комплекс анализов сложно и дорого. Однако, благодаря начатым еще в 90-е гг. научным исследованиям по расшифровке молекулярных механизмов воспалительного ответа, в настоящее время выявлено множество так называемых маркеров воспаления, продолжаются поиски предиктов сепсиса. Причем, достижения фундаментальной науки очень быстро становятся достоянием практики благодаря бурному развитию высокотехнологичной лабораторной медицины. Тем не менее, уровень летальности от сепсиса во всем мире остается крайне высокой, а диагностика носит констатирующий, но не опережающий характер.
Основными проблемами, на наш взгляд, являются: отсутствие мониторинга у конкретного больного, отсутствие сравнительной базы данных и однозначная интерпретация полученных результатов с позиций воспалительной интоксикации.
Цель. Оптимизация лабораторной диагностики сепсиса путем оценки адаптивного уровня воспалительного ответа на ожоговую травму.
Объект и методы исследования. Для достижения поставленной цели мы использовали как современные маркеры воспаления, доступные высокотехнологичным лабораториям и клиникам, так и продолжили фундаментально-прикладные исследования по расшифровке воспалительного ответа на уровне индукции экспрессии некоторых регуляторных факторов.
Всего обследовано 476 пациентов с ожогами общей площадью поражения от 30% поверхности тела и более с благоприятным и неблагоприятным исходом в острый период адаптации к травме. Используемые методы исследования включали: Экспресс – диагностика маркеров воспаления и сепсиса: пресепсин — количественное определение иммунохемилюминесцентным методом (PATHFAST, Япония), прокальцитонин – полуколичественное измерение иммунохроматографическим методом (BRAHMS PCT – Q, Германия); С-реактивный белок – количественное определение иммунохемилюминесцентным методом (AQT-90, Дания). Бактериологический анализ гемокультуры (Bactec 9050). Экспрессия мРНК цитокинов и факторов методом ПЦР. Полимеразную цепную реакцию в реальном времени (РТ-ПЦР) проводили с использованием специфических праймеров к ДНК MIF, HIF, hTERT, а также ревертазы, b-актина, Tag-полимеразы (реактивы фирмы «Синтол») на отечественном анализаторе нуклеиновых кислот АНК – 32. Мониторинг накопления амплифицированного продукта осуществляли с помощью флюоресцентного сигнала.
Обзор литературы. Наиболее широко используемым маркером инфекции у больных, находящихся в критическом состоянии, является С — реактивный белок (CRP) — один из центральных компонентов острой фазы, общепризнанный «золотой маркер» воспалительных процессов. При этом, он «узнает» как инфекционные агенты, так и неинфекционные. Уровень CRP коррелирует с тяжестью воспалительного процесса (2). В целом, CRP имеет много свойств, характерных для иммуноглобулинов: он связывается с бактериальными полисахаридами и гликолипидами, с поврежденными мембранами и с экспонированными ядерными антигенами. А это, в свою очередь, приводит к связыванию с C1q и к активации классического каскада комплемента, что в результате вызывает фиксацию расщепленных продуктов фаголитического комплемента. CRP также связывается с Fc-рецепторами и повышает фагоцитоз определенных антигенов и микроорганизмов (3).Синтез CRP увеличивается уже через 6 часов после стимуляции цитокинами, глюкокортикоидами, факторами роста и другими медиаторами воспаления, а концентрация в крови возрастает в 10-100 раз в течение 24-48 часов после начала воспаления. Период полураспада в плазме составляет около 19 часов (2).
Наиболее высокие уровни CRP (более 100 мг/л) наблюдаются при бактериальной инфекции. При вирусной — концентрация CRP, как правило, не превышает 30 мг/л. Содержание CRP также повышается при некрозе тканей (в том числе при инфаркте миокарда, опухолевом распаде). При тяжелых генерализованных инфекциях, ожогах и сепсисе превышение CRP может быть почти запредельным.
Однако, данные по чувствительности и специфичности варьируют в разных публикациях. По мнению ряда экспертов, выявление тенденции в изменении содержания CRP может быть более полезно, чем просто определение абсолютной концентрации метаболита (2-7). Также необходимо подчеркнуть, что измерения концентраций CRP должны проводиться в комплексе с измерениями других биохимических и иммунологических показателей, выбор которых может диктоваться многими факторами (3). И наиболее актуальный из них — комплексная диагностика сепсиса. Необходимо отметить, что в настоящее время количество биомаркеров воспаления и сепсиса приближается к 200 и подчас опережает раскрытие механизма их образования и действия. При этом наиболее востребованным остается прокальцитонин (PCT).
Более 30 лет назад появились первые сообщения о повышении концентрации PCT у больных с обширными ожогами. С тех пор исследователи пытаются выяснить – является ли он специфическим маркером инфекции (6). Однако изначально PCT позиционировался как маркер полиорганной недостаточности (ПОН), которая оценивалась по показателям SOFA. Так, более высокие уровни значений SOFA были связаны со значительно более высокими плазменными концентрациями РСТ: SOFA 7-12 и PCT 2.62 ng/ml; SOFA 19-24 и PCT 15.22 ng/ml (8). В то же время появились публикации с данными о PCT как маркере воспаления (9, 10). Системный воспалительный синдром неинфекционной этиологии также ведет к повышению уровней прокальцитонина. Пациенты после тяжелой травмы или операции, с острым респираторным дистресс синдром, острой реакцией трансплантат против хозяина, системной грибковой инфекцией, ожогами, опухолями могут иметь повышенные уровни прокальцитонина без каких либо признаков наличия тяжелых инфекций, в связи с массовой гибелью клеток (2, 10-12). Однако, средние значения при этих состояниях обычно меньше чем, в течение тяжелого сепсиса и септического шока (10). Тем не менее, в последующих исследованиях авторы сконцентрировали внимание на сравнительных (в аспекте инфекционных осложнений) характеристиках CRP, PCT и числа лейкоцитов и пришли к выводу, что специфичность и чувствительность PCT выше (13-15). Более того, по уровню прокальцитонина предложено корригировать назначение антибиотиков (8).
При микробной инфекции провоспалительные медиаторы и бактериальные токсины индуцируют рост синтеза PCT из всех паренхиматозных органов и тканей (печень, жировая ткань, почки, мышцы). Некоторые авторы считают, что это происходит посредством увеличения экспрессии CALC-I гена и индукции PCT во всех тканях и типах клеток организма. Таким образом, при септических состояниях весь организм может рассматриваться как эндокринная железа (2). В настоящее время ведутся исследования по иммунонейтрализации PCT антителами, с чем связывают надежды на успехи в лечении сепсиса (12).
Уровни PCT, нормальные и патологические. В норме, как ранее полагалось, концентрация PCT в плазме составляет менее 0,1нг/мл. Уровни PCT при СВО без инфекции как правило, менее 1 нг/мл. При локальных бактериальных инфекциях без системных проявлений уровень PCT возрастает незначительно (0,3 – 1,5 нг/мл). Уровень PCT от 0,5 до 2 нг/мл находятся в «серой зоне», в которой диагноз сепсиса с уверенностью поставить нельзя. В этих случаях рекомендуется повторить измерения через 6 — 24 часов. Уровень PCT выше 2 нг/мл с высокой вероятностью свидетельствует об инфекционном процессе с системным воспалением (2, 11, 12). При септицемии уровень PCT повышен, обычно выше 2 нг/мл. Высокие уровни PCT при бактериемии всегда предсказывают тяжелое течение и указывают на плохой прогноз. Уровни PCT выше 10 нг/мл наблюдается почти исключительно у пациентов с тяжелым сепсисом или септическим шоком. У пациентов с сепсисом, тяжелым сепсисом и септическим шоком концентрация PCT может достигать 1000 нг/мл (30)! Однако использование PCT в качестве маркера сепсиса имеет ряд ограничений: 1) не существует единого уровня cut-off, 2) наличие ложноположительных и ложноотрицательных результатов (2).
Известно, что реализация воспалительного ответа — прерогатива клеток, которые выполняют функции узнавания чужеродного антигена, его нейтрализации и представления иммунным клеткам для синтеза специфических антител. При этом на поверхности клеток активируются многочисленные антигены, рецепторы, степень экспрессии которых отражает уровень воспалительного ответа. В частности, предложенный в последние годы очередной биомаркер – пресепсин – относится к этой группе и позиционируется как ранний, специфичный и чувствительный предикт сепсиса (12, 16-18). Исследование ROC- кривой пациентов с СВО без инфекции и с сепсисом показало, что концентрация пресепсина – более чувствительный индикатор сепсиса и полезный маркер для его срочной диагностики: пресепсин — 0.85, PCT — 0.65, CRP — 0.815, IL-6 – 0,672 (16, 18).
Пресепсин – метаболит мембранного рецептора CD14, экспрессирующегося на поверхности моноцитов/макрофагов, нейтрофилов, хондроцитов, дендритных клеток, B-лимфоцитов и других зрелых клеток. Однако главную роль в образовании пресепсина играют активированные макрофаги (12, 18). mCD14 «узнают», например, липополисахарид (ЛПС) и самостоятельно или с помощью липополисахарид-связывающего белка (ЛСБ) передают сигнал внутрь макрофага через трансмембранный белок TLR4 (толл-подобный рецептор). После выполнения своей функции mCD14 метаболизируется и попадает в кровь в растворимой форме sCD14. Дальнейший протеолиз sCD14 приводит к образованию двух метаболитов, наиболее стабильным из которых является фрагмент sCD14-ST – пресепсин (12, 18). Результаты опытов на животных позволяют полагать, что в образовании sCD14-ST большую роль играют лизосомальные протеазы. В частности, одним из ферментов, фрагментирующим sCD14 является катепсин D, что, по-видимому, представляет основной путь образования пресепсина у септических больных (12, 18).
Основным триггером клеточной гибели выступает гипоксия. Современные молекулярные механизмы адаптации клеток к гипоксии включают активацию факторов, способствующих репарации клетки.
Центральную роль в компенсации последствий клеточной гипоксии играет фактор, индуцированный гипоксией, — HIF-1α. Это транскрипционный фактор, регулирующий экспрессию генов, отвечающих за процесс ангиогенеза, вазомоторный контроль, энергетический метаболизм, эритропоэз (усиление синтеза эритропоэтина) и апоптоз. Индукция ангиогенеза происходит посредством экспрессии ростовых факторов VEGF-A, VEGFR-1 и 2, IL-8, PDGF, усиления активности металлопротеиназ (MMP-9) и т.д. (19-21). Несомненно, HIF-1α, работая в условиях гипоксии, имеет колоссальное значение для возникновения, роста и метастазирования опухоли, поэтому HIF-1α – известный онкомаркер (22).
Адаптивная роль фактора, индуцированного гипоксией, распространяется на регуляцию врожденного иммунитета. Продемонстрирована прямая корреляция стимуляции активности HIF-1α и экспрессии TLR2 и TLR6 рецепторов (23). Более того, он участвует в индукции миграции стволовых клеток костного мозга (по крайней мере, гемопоэтических). Стимулом к мобилизации из ниши служат молекулярные сигналы из очага повреждения. За последнее время был изучен такой механизм, обусловленный взаимодействием stromal cell-derived factor-1 (SDF-1) и его рецептора — CXCR4 на поверхности клеток. Экспрессия CXCR4 установлена на поверхности гемопоэтических, мышечных, нейральных и эндотелиальных прогениторах. Однако остаётся неясным, что заставляет вырабатывать SDF-1 в повреждённой ткани и вызывать, тем самым, усиленную миграцию стволовых клеток в очаг неблагополучия. Наконец, было установлено, что локальный синтез SDF-1 регулируется молекулой hypoxia-inducible factor-1 (HIF-1α), играющей центральную роль в клеточном ответе и защите на фактор гипоксии. При блокаде HIF-1α не наблюдалось гипоксия-зависимого синтеза SDF-1. То есть выработка HIF-1α при гипоксии первична и обуславливает экспрессию SDF-1 (24). HIF-1 способен стимулировать дифференцировку ЭС клеток путем ингибирования LIF-STAT3 системы передачи сигнала, ответственной за поддержание плюрипотентности ЭС клеток (25). В последние годы были разработаны препараты, повышающие стабильность факторов гипоксии (ингибиторы HIF пролил-гидроксилазы), что приводит к росту эндогенной продукции эритропоэтина (2).
Процесс воспаления всегда затратен энергетически и из-за клеточного потребления и требует постоянного клеточного обновления. Универсальным маркером клеточной пролиферации является теломераза. Она играет заметную роль в процессе репарации ДНК путем репликации концевой ее части и в физиологических условиях активна в постоянно-обновляемой клеточной популяции: в некоторых соматических клетках костного мозга, лейкоцитах периферической крови, в Т- и В- лимфоцитах, в семенниках, эпидермисе кожи и эпидермисе шейки матки, в клетках нижней части крипт толстой кишки (26, 27).
Теломераза состоит из каталитической субъединицы (hTERT — telomerase reverse transcriptase), РНК — субъединицы (hTR), выполняющей роль матрицы при наращивании ДНК, и ассоциированных белков. В отличие от РНК-компонента, экспрессирующегося во всех типах клеток, hTERT мРНК не обнаруживается в теломеразонегативных клетках (26, 27). Необходимо добавить, что метаболизм теломер и внутриклеточных органелл сопряжены, например, дисфункция теломер вызывает метаболические проблемы в митохондриях (28).
В связи с вышесказанным, логично предположить усиление экспрессии hTERT- компонента теломеразы в клетках периферической крови при системном воспалительном ответе в ряду адаптивных реакций, направленных на восполнение клеточного дефицита.
Среди медиаторов, обладающих интегрально-регуляторными функциями в процессе воспалительного ответа, колоссальную роль играет ингибитор миграции макрофагов (MIF), способствующий локализации фагоцитов в очаге инфекции. Оказалось, что этот низкомолекулярный белок (12,5 кДа) широко распространен в биологических объектах, максимальное его количество обнаружено в макрофагах и ткани мозга, а также в активированных Т- и В-лимфоцитах, моноцитах.
MIF обладает многоплановым биологическим действием, поэтому он представляет научно-практический интерес для понимания патогенеза воспаления и возможности воздействия на него. Свою полифункциональность, обусловленную существованием медиатора в различных изоформах и олигомерных структурах, MIF проявляет как: 1) цитокин (индуцирует выработку провоспалительных цитокинов и тормозит — антивоспалительных), 2) гормон (основной его регулятор – гипоталамический кортиколиберин) и 3) фермент (тиолзависимый фермент, включающий в свой состав ароматические АК (Tyr, Trp, Pheн) и 3 цистеина (Cys-57, 60, 81). MIF участвует в защитных механизмах при тепловом шоке: он обладает шапероноподобными свойствами, тормозя агрегацию субстратов при тепловом шоке, сопровождаемым денатурацией лабильных белков. Выявлено усиление высвобождения медиатора из клеток под действием глюкокортикоидов (ГК), сопровождаемое повышением экспрессии провоспалительных цитокинов то есть, MIF — участник неспецифической стрессовой реакции, индуцируемой гипоталамо-гипофиз-адреналовой системой. При этом генетический анализ показал наличие всего одного гена MIF у человека и нескольких генов у мышей. У человека в физиологических концентрациях он имеет олигомерную структуру с преобладанием димеров (29).
Результаты и обсуждение.
В связи с многочисленными публикациями о преимуществе CRP или PCT в диагностике сепсиса мы провели одновременную оценку этих показателей у тяжелообожженных пациентов в динамике и соотнесли их значение с бактериологическим анализом гемокультуры. Однако на первом этапе мы решили выяснить, имеются ли различия в микробном спектре биологических образцов пациентов с сепсисом на фоне глубоких и обширных ожогов с благоприятным и неблагоприятным исходом.
Для этого нами проведен контроль инфекции в ране, биоптате и биологических жидкостях, а также мониторинг маркеров воспаления у 20 выживших и 24 тяжелообожженных с летальным исходом в периоды 1990-х гг.(I) и в 2010-х гг.(II).
Несмотря на проведение комплексной высокотехнологичной терапии с применением современных антибиотиков, назначаемых строго по чувствительности, у пациентов, независимо от исхода, отмечалась выраженная (до10,28) персистирующая микробная обсемененность. По-видимому, имеется недостаточная проникающая способность антибиотиков, связанная с периферической дисциркуляцией на фоне полиорганной недостаточности.
В бактериальном спектре у всех пострадавших преобладала Г (-) флора. При этом бактериемия не была облигатным признаком. Однако, если в I группе больных, независимо от исхода, соотношение основных представителей микроорганизмов, Staphylococcus aureus и Pseudоmonas aeruginosa, было одинаково, то через 20 лет (во II группе) ситуация изменилась в пользу синегной палочки: 33% против 13%. Общее преобладание Г- флоры также увеличилось по сравнению с I группой c 25% до 31%. В этой связи, необходимо отметить значительное увеличение высеваемости Klebsiella pneumoniae на 9,8%. Рост грибов рода Candida составил 5,6%.
Именно в связи с тем, что бактериемия стала необлигатным признаком для диагностики сепсиса, востребованность в исследовании PCT остается высокой и имеет тенденцию к росту: 2011г. – 203, 2012г. – 309 и 2013 — 367 анализов при примерно одинаковом числе госпитализированных пациентов. Отмечен также рост «отрицательных» результатов PCT (≤0,5≥) с 67% от общего числа исследований до 77%. Частота результата, отражающего угрозу генерализации инфекции (≤10≥), составила всего 10-13% от общего числа обследованных за три года.
Из 42 больных с угрозой развития сепсиса (PCT≤10≥) 20 пациентов выжили, а 22 — имели неблагоприятный в дальнейшем исход. Из тех же 42 больных бактериемия наблюдалась у 23 (54%), при этом в группе выживших она зафиксирована у 13 больных (65%), в группе погибших – у 10 пациентов (45%). Наиболее частыми представителями микрофлоры явились S.aureus, P.aeruginosa и Acinetobacter spp.
Необходимо отметить, что все пострадавшие с неблагоприятным в дальнейшем исходом имели диагноз «сепсиса», среди выживших больных с угрозой генерализации инфекции по анализу PCT данный диагноз выставлен у 10 (50%).
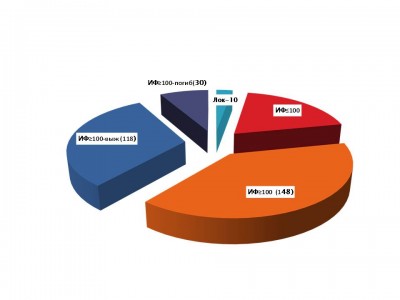
Рис. 1 PCT (n=230):структура пациентов
Нами проведен дальнейший более детальный анализ базовых результатов с включением исследования CRP и P-SEP в зависимости от развившегося сепсиса и исхода, который продемонстрировал резкие отличия в уровне воспалительного ответа на травму. У пациентов I группы, несмотря на локальность поражения, выявлено повышение CRP: М=13.68 mg/l ±2.87 (n=7) на фоне нормальных значений P-SEP: 21.3±4.3 pg/ml (n=6) и PCT (<0.5 ng/ml). Пострадавшие II группы имели системный воспалительный ответ (СВО) на обширное поражение, что отразилось в повышении CRP: m=57.69±5.87 mg/l (n=13) и P-SEP: 81.3±17.7 pg/ml (n=16), при этом PCT оставался в пределах ≥0.5 ng/ml с эпизодами до 2 ng/ml. Наиболее тяжелые больные III и IV групп продемонстрировали резкие отличия в уровне воспалительного ответа на травму. А именно: выявлено логичное повышение CRP: М=166 mg/l±20.86 (n=13) и P-SEP: 451.15±44.03 pg/ml (n=26) с периодическими подъемами PCT до 2-10 ng/ml (n=59) у всех пациентов III группы. Однако в «септической» составляющей с благоприятным исходом (IIIa) отмечен дальнейший рост P-SEP: 632.3 pg/ml±74.26 (n=10) и PCT (частый тренд к 10 ng/ml) на фоне относительного снижения CRP: m=137.6±27.4 mg/l (n=16). Наконец, у больных IV группы (сепсис, неблагоприятный в дальнейшем исход) отмечено при поступлении сравнительное снижение P-SEP: 402.66±67.49 pg/ml (n=9) и CRP: М=110.56±24.52 mg/l (n=9) при cтойком тренде PCT≥10 ng/ml (рис.2).
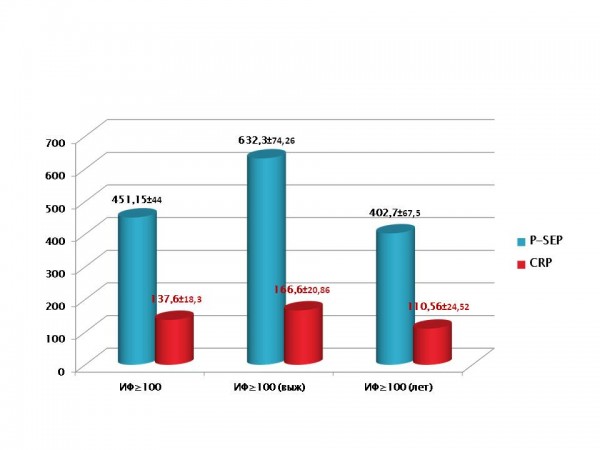
Рис.2 Базовые значения маркеров при тяжелой ожоговой травме
(неблагоприятный прогноз).
Дальнейший мониторинг этих больных (IV группа) демонстрировал подъем P-SEP до: 6488.1 pg/ml±1926.97. При этом у выживших пострадавших IIIа группы отмечено менее значительное повышение P-SEP: 2098.0±875.77 pg/ml (рис. 3).
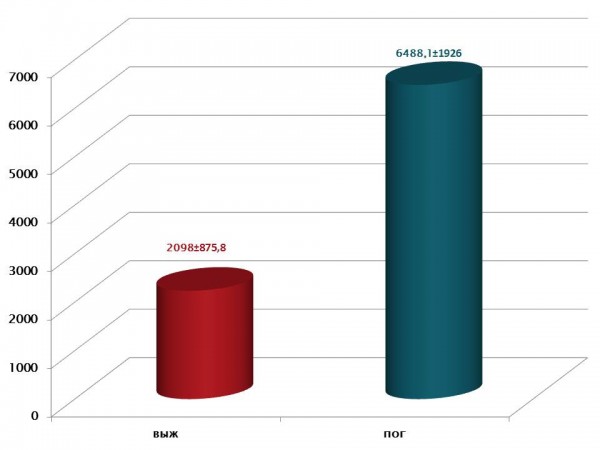
Рис. 3 Мониторинг P-SEP при ожоговой травме (n=25).
Выявлено также, что у выживших пациентов с пневмонией уровень P-SEP достигал более высоких цифр, чем без пневмонии: 2922.8±1711.98 pg/ml (n=5) по сравнению с 1744.88±534.90 (n=8) (рис. 4).
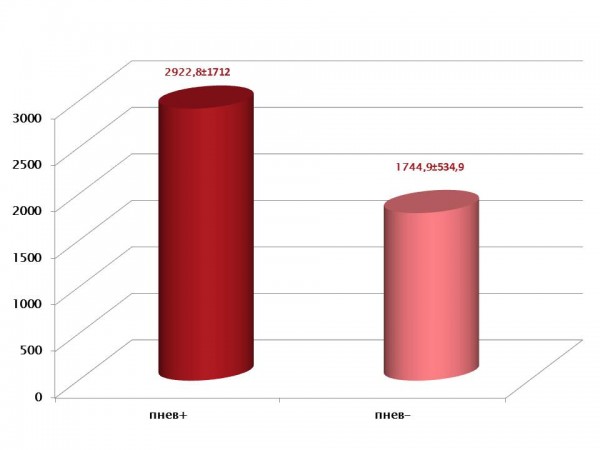
Рис. 4 Сравнительный мониторинг P-SEP
у выживших тяжелообожженных
Таким образом, комплексная диагностика тяжелообожженных с исследованием нескольких маркеров СВО позволяет оценить адаптивность воспалительного ответа тяжести повреждения и прогнозировать угрозу генерализации инфекции. При этом CRP и P-SEP в большей степени маркеры уровня воспаления, тогда как PCT – маркер угнетения адаптивного воспаления, сопровождаемого развитием ПОН и тяжелого сепсиса.
Нами проведен анализ результатов уровня экспрессии мРНК HIF-1α и hTERT в клетках крови пациентов с ожогами более 30% поверхности тела и благоприятным исходом в количестве 10 человек. Выявлено, что в условиях гипоксии, например, в острый период после травмы или после операции (стрессорное воздействие), у тяжелообожженных выживших пациентов наблюдалось повышение экспрессии мРНК этих маркеров в десятки раз — до 30% относительно β-актина. Однако, генерализация инфекции происходила на фоне ее резкого относительного снижения – до 0,5% — 2%. Кроме того, экспрессия мРНК исследуемых генов отличалась не только в зависимости от тяжести ожога и состояния пострадавшего, но и сроков после травмы. Например, уровень мРНК hTERT в ранний период (2 сутки) у пациентов средней степени тяжести составил в среднем 0,066% к экспрессии β-актина, а к 24 суткам – 0,17%. В целом, активность мРНК HIF-1α в острый период была выше, чем мРНК hTERT, что логично для компенсации гипоксии в ранний период и усиления пролиферации на более позднем этапе.
Сверхэкспрессия мРНК HIF-1α в клетках крови тяжелообожженного пострадавшего является адаптивной реакцией на клеточную гипоксию. Угнетение активности мРНК HIF-1α и мРНК hTERT при наличии тяжелого повреждения, осложненного сепсисом, – дезадаптивная реакция. Мониторинг экспрессии клеточных маркеров адаптации может иметь прогностическую ценность в условиях комплексной диагностики при термической травме.
Результаты исследования экспрессии м-РНК MIF у пациентов разной степени тяжести также продемонстрировали различия в ее уровне. У стабильно-тяжелых больных с СВО выявлен высокий уровень продукции цитокина (от 1,5 до 5,6% сравнительно с экспрессией β-актина), в то время, как у пострадавших с тяжелым сепсисом и неблагоприятным прогнозом обнаружена тенденция к угнетению экспрессии м-РНК MIF от 0,17 до 0,8%. Относительное снижение экспрессии МИФ, по-видимому, — одно из проявлений антивоспалительной системной реакции, обуславливающее снижение резистентности организма к инфекции.
Заключение. Современная наука стремительно расшифровывает клеточно-молекулярные механизмы воспаления. В настоящее время доказано, что системное воспаление — это не только системная альтерация, но прежде всего, генетически-детерминированный универсальный процесс, запускаемый нейро-эндокринными и цитокиновыми медиаторами и направленный на сохранение антигенного гомеостаза. И задача клинициста заключается в том, чтобы выявить это главное предназначение воспалительного ответа в «метаболической анархии», развивающейся в организме пациента, находящегося в тяжелом и, тем более, критическом состоянии. Ключом к решению данной проблемы является использование концепции адаптации и выделение адаптивных, способствующих удалению чужеродных АГ, и дезадаптивных, свидетельствующих об ослаблении этих функций, - реакций в структуре ответа на тяжелую травму или заболевание.
На основании результатов предыдущих исследований нами продемонстрировано, что для благоприятного исхода при тяжелой ожоговой травме характерна умеренно-выраженная воспалительная реакция. А дисбаланс между про — и противовоспалительными системами может привести либо к разрушительному гипервоспалению либо к параличу иммунной системы и развитию сепсиса. Оба состояния связаны с развитием полиорганной недостаточности и высоким уровнем смертности. Поэтому важны исследования, направленные на выявление защитных механизмов, которые модулируют иммунный ответ после травмы или сепсиса (1, 30).
То есть, определение провоспалительной и антивоспалительной составляющих ответной реакции на ожоговую травму является важнейшим отправным моментом для решения данной проблемы у каждого конкретного больного. В «эпоху маркеров» воспаления оценить его уровень легко. Гораздо сложнее определить его адаптивность, т.е. адекватность тяжести травмы или состояния. Для этого необходим, во-первых, мониторинг у данного больного и, во-вторых, сравнительный мониторинг, т.е., соотнесение его к «базе данных» по пациентам с подобной травмой и благоприятным или неблагоприятным исходом.
Основной вывод по результатам проведенных в настоящей работе исследований заключается в том, что «маркеры воспаления» не могут быть тождественны «маркерам сепсиса». И их диагностическая значимость заключается, в первую очередь, в отражении уровня воспаления, так как большинство из них являются продуктами воспалительных клеток, прежде всего, фагоцитарных.
Характерно, что базовые данные по CRP и P-SEP очень четко это демонстрируют: изначально активация фагоцитоза соответствует тяжести травмы (адаптивная реакция), но она не беспредельна, и у пострадавших с неблагоприятным прогнозом уже на ранних этапах после травмы отмечается относительное угнетение воспаления (дезадаптивная реакция). У пациентов с летальным в дальнейшем исходом это наиболее выражено.
Причины срыва адаптации заключаются в стремительном потреблении провоспалительных клеток, противовоспалительном статусе, энергодефиците и т.д.
Сравнительный мониторинг CRP и P-SEP показывает постепенный спад воспалительного ответа у пострадавших средней степени тяжести по мере заживления ран и устранения чужеродной антигенемиии. Однако при неблагоприятном прогнозе, а тем более исходе, мы наблюдаем рост этих маркеров. Первоочередная причина, на наш взгляд, — системность продукции. Как описано с прокальцитонином: весь организм становится эндокринной железой (2, 11). Другая причина, по-видимому, кроется в усилении системного протеолиза и выходе mCD14 в кровь (sCD14) до выполнения им основной функции. Дальнейший его метаболизм приводит к образованию пресепсина в большом количестве.
Касательно прокальцитонина: конкретных данных о его роли в воспалении до настоящего времени не существует. Предполагается, что он может быть вторичным посредником на уровне клетки. Кроме того, изначально он позиционировался как маркер ПОН. Все вместе взятое нам импонирует, так как результаты наших исследований большей частью демонстрируют рост прокальцитонина в случае дезадаптивно низких или высоких значений CRP и P-SEP. Т.е., мы приходим к выводу, что PCT – маркер угнетения адаптивного воспаления, он свидетельствует о его недостаточности.
Экспрессия исследуемых медиаторов – функция их генов, в конечном итоге — клетки. Более выраженное усиление экспрессии фактора, индуцируемого гипоксией, и фактора – ингибитора миграции макрофагов у пострадавших с тяжелыми ожогами – адаптивная реакция острой фазы. Относительное снижение мРНК этих генов, наблюдаемое при неблагоприятном прогнозе – дезадаптивная реакция, свидетельствующая о функциональной неполноценности воспалительных клеток, также лежащей в основе общего угнетения ответа. Торможение репарации (по экспрессии hTERT) – дополнительный аргумент данного аспекта.
Таким образом, несмотря на значительные принципиальные изменения микробного спектра при ожоговом сепсисе, неизменным остается срыв адаптивного воспаления как патогенетическая основа развития этого жизнеопасного осложнения. В связи с чем, одной из основных задач комплексной терапии при тяжелой ожоговой травме должно быть восстановление адаптивного ответа путем заместительной клеточной терапии, снижения детоксикационной составляющей, преобладания стимуляции ответной реакции организма.
Опережающая диагностика осложнений ожоговой болезни – основная цель лабораторного обследования. Сформулировав концепцию сепсиса как срыва адаптивного воспаления, мы видим основной путь (алгоритм) преддиагностики генерализации инфекции в определении адаптивности уровня воспалительного ответа на травму (31).
СПИСОК ИСПОЛЬЗОВАННЫХ РАБОТ.
- Ушакова Т.А. Адаптация к ожоговой травме: проблемы и перспективы// Ж. Комбустиология, электр.версия № 39/2009, combustiolog.ru.
- www.biochemmack.ru
- Вельков В.В. С-реактивный белок — «золотой маркер», многозначительный и незаменимый/http: diakonlab.ru
- S.P.Pinheiro, M.C.Caetano, R.C. Carvalho, F.R. Rodrigues, L.C. Cabral, G.Ribeiro, C.C. Cruzeiro. Infection biomarkers in burn patients – a retrospective study. 14th European Burns Assotiation Congress, 2011, P.110.
- Yo CH, Hsieh PS, Lee SH, Wu JY, Chang SS, Tasi KC, Lee CC. Comparison of the test characteristics of procalcitonin to C-reactive protein and leukocytosis for the detection of serious bacterial infections in children presenting with fever without source: a systematic review and meta-analysis. Ann Emerg Med. 2012 Nov;60(5):591-600. doi: 10.1016/j.annemergmed.2012.05.027. Epub 2012 Aug 22.
- Wu JY, Lee SH, Shen CJ, Hsieh YC, Yo PH, Cheng HY, Chan RC, Lee CC, Chang SS. Use of serum procalcitonin to detect bacterial infection in patients with autoimmune diseases: a systematic review and meta-analysis. Arthritis Rheum. 2012 Sep;64(9):3034-42. doi: 10.1002/art.34512.
- Lin SG, Hou TY, Huang DH, He SY, Lin YD, Zhang LY, Hsieh PS. Role of procalcitonin in the diagnosis of severe infection in pediatric patients with fever and Neutropenia—a systemic review and meta-analysis. Pediatr Infect Dis J. 2012 Oct;31(10):e182-8. doi: 10.1097/INF.0b013e31825da45d.
- Meisner M., Tschaikowsky K., Palmaers T., and Schmidt J. Comparison of procalcitonin (PCT) and C-reactive protein (CRP) plasma concentrations at different SOFA scores during the course of sepsis and MODS Crit Care 1999 3: 45-50.
- Mimoz O., Benoist JF., Edouard AR., Assicot M., Bohuon C., Samii K. Procalcitonin and C-reactive protein during the early posttraumatic systemic inflamatory responce syndrome., Intensive Care Med 1998; 24: 185-8.
- Meisner M, Tschaikowsky K, Hutzler A, Schick C, and Schuttler J Postoperative plasma concentrations of procalcitonin after different types of surgery. Intensive Care Med (1998) 24:680-684.
- Зубарев А. Прокальцитонин — новый маркер для диагностики тяжелой инфекции (обзор)/ criticare.chat.ru.
- Вельков В.В. Пресепсин – ранний маркер сепсиса. Лаборатория, №3, 2012, с. 7-10.
- Yo CH, Hsieh PS, Lee SH, Wu JY, Chang SS, Tasi KC, Lee CC. Comparison of the test characteristics of procalcitonin to C-reactive protein and leukocytosis for the detection of serious bacterial infections in children presenting with fever without source: a systematic review and meta-analysis. Ann Emerg Med. 2012 Nov;60(5):591-600. doi: 10.1016/j.annemergmed.2012.05.027. Epub 2012 Aug 22.
- Wu JY, Lee SH, Shen CJ, Hsieh YC, Yo PH, Cheng HY, Chan RC, Lee CC, Chang SS. Use of serum procalcitonin to detect bacterial infection in patients with autoimmune diseases: a systematic review and meta-analysis. Arthritis Rheum. 2012 Sep;64(9):3034-42. doi: 10.1002/art.34512.
- Lin SG, Hou TY, Huang DH, He SY, Lin YD, Zhang LY, Hsieh PS. Role of procalcitonin in the diagnosis of severe infection in pediatric patients with fever and Neutropenia—a systemic review and meta-analysis. Pediatr Infect Dis J. 2012 Oct;31(10):e182-8. doi: 10.1097/INF.0b013e31825da45d.
- Vodnik T, Kaljevic G, Tadic T, Majkic-Singh N. Presepsin (sCD14-ST) in preoperative diagnosis of abdominal sepsis. Clin Chem Lab Med. 2013 Jun 5:1-10. doi: 10.1515/cclm-2013-0061.
- E. Spanuth1, H. Ebelt2, B. Ivandic1and K. Werdan2. Diagnostic and prognostic value of presepsin (soluble CD14 subtype) in emergency patients with early sepsis using the new assay PATHFAST Presepsin.
- Shozushima T, Takahashi G, Matsumoto N, Kojika M, Okamura Y, Endo S. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother. 2011 Dec;17(6):764-9. doi: 10.1007/s10156-011-0254-x. Epub 2011 May 12.
- Suzanne a. Eccles. Parallels in invasion and angiogenesis provide pivotal points for therapeutic intervention/ Int. J. Dev. Biol. 48: 583-598 (2004).
- Panferov A.S, Napalkov D.A., Sulimov V.A., Levina A.A., Manukova Y.I. Changes in hypoxia-inducible factor (HIF-1 alpha) in patients with chronic heart failure and systolic dysfunction of left ventricle. European Journal of Heart Failure Supplements 2009; 8(2).
- М.Ю. Швецов, А.А. Иванов, О.П. Попова, А.В. Кузнецова, А.С. Рамеева. Взаимосвязи почечной экспрессии фактора, индуцируемого гипоксией, с выраженностью нефросклероза и анемии при хроническом гломерулонефрите/Клиническая нефрология №2, 2009.
- Adrian Staab, Jürgen Loeffler, Harun M Said, Désirée Diehlmann, Astrid Katzer, Melanie Beyer, Markus Fleischer, Franz Schwab, Kurt Baier, Hermann Einsele, Michael Flentje and Dirk Vordermark. Effects of HIF-1 inhibition by chetomin on hypoxia-related transcription and radiosensitivity in HT 1080 human fibrosarcoma cells/ BMC Cancer 2007, 7:213doi:10.1186/1471-2407-7-213.
- Kuhlicke J, Frick JS, Morote-Garcia JC, Rosenberger P, Eltzschig HK (2007). Hypoxia Inducible Factor (HIF)-1 Coordinates Induction of Toll-Like Receptors TLR2 and TLR6 during Hypoxia/ PLoS ONE 2(12): e1364. doi:10.1371/journal.pone.0001364
- Hitchon C, et al. Hypoxia-induced production of stromal cell-derived factor 1 (CXCL12) and vascular endothelial growth factor by synovial fibroblasts. Arthritis Rheum 2002; 46: 2587-2597
- Гривенников И. А. Эмбриональные стволовые клетки и проблема направленной дифференцировки/ Успехи биологической химии, т. 48, 2008, с. 181–220.
- Смолянинов А.Б., Жаров Е.В., Новикова П.Ю., Смирнова Н.В. Теломеры, стволовые клетки и клеточное старение организма/
- Дашинимаев Э. Б. Введение гена каталитического компонента теломеразы (hTERT) в клетки с различным дифференцировочным потенциалом / http://www.dissercat.com/content/vvedenie-gena-kataliticheskogo-komponenta-telomerazy-htert-v-kletki-s-razlichnym-differentsi#ixzz310o3OmHX.
- Sahin E, Colla S, Liesa M, Moslehi J, Müller FL, Guo M, Cooper M, Kotton D, Fabian AJ, Walkey C, Maser RS, Tonon G, Foerster F, Xiong R, Wang YA, Shukla SA, Jaskelioff M, Martin ES, Heffernan TP, Protopopov A, Ivanova E, Mahoney JE, Kost-Alimova M, Perry SR, Bronson R, Liao R, Mulligan R, Shirihai OS, Chin L, DePinho RA. Telomere dysfunction induces metabolic and mitochondrial compromise. Nature. 2011;470(7334):359.
- Черепкова О.А., Лютова Е.М., Гурвиц Б.Я. Фактор ингибирования миграции макрофагов: выделение из мозга быка/ Биохимия, 2006, т.71, вып1, с 90-96.
- Roman Pfeifer, Thomas Tschernig, Philipp Lichte, Derek Dombroski, Philipp Kobbe and Hans-Christoph Pape. MALP-2 pre-treatment modulates systemic inflammation in hemorrhagic shock/ Journal of Inflammation: Published online: 12 April 2013 Background.
- Алексеев А.А., Ушакова Т.А., Крутиков М.Г., Бобровников А.Э. Маркеры сепсиса в диагностике адаптивного воспаления при ожоговой травме / Лечение и профилактика, 2015, 2 (14) / 2015, с.84-91.