ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Микробиологическая оценка эффективности современных антимикробных препаратов для местного лечения ожоговых ран
Алексеев А.А.
Бобровников А.Э.
Терехова Р.П.
Крутиков М.Г.
ФГУ «Институт хирургии им.А.В.Вишневского Росмедтехнолгогий», кафедра термических поражений, ран и раневой инфекции РМАПО, Москва.
Главенствующая роль инфекции в патогенез не только ожоговых ран, но и ожоговой болезни является общепризнанным фактом и остается одной из основных причин развития осложнений и летальных исходов у обожженных (Polk H.C., 1979; Кузин М.И. с соавт., 1982; Mackie D.P., 1992; Вихриев Б.С., Бурмистров В.М., 1986; Goodwin C.W., Yurt R.W., 1986 Pruit B.A., 1998; Азолов В.В. с соавт., 1999; Алексеев А.А., 1993, 1999). При этом улучшение контроля над раневой инфекцией во многом связано с применением местных противомикробных средств, которые используются для ее профилактики и лечения, как при непосредственной обработке ожоговых ран, так и в составе влажновысыхающих, мазевых и других раневых повязок.
Появление высокорезистентных к применяемым антибактериальным препаратам штаммов микроорганизмов – возбудителей ожоговой инфекции диктует необходимость рационального использования имеющихся и поиска новых эффективных местных антимикробных средств. Целью данной работы явилось поведение микробиологической оценки эффективности современных наиболее широкго применяемых в комбустиологии антимикробных препаратов для местного лечения.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
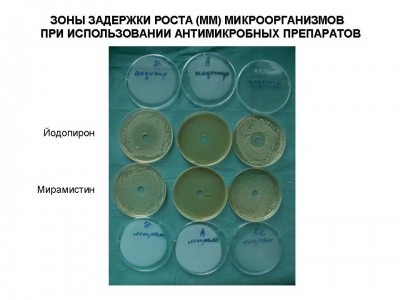
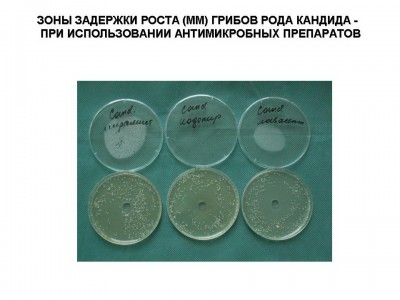
Были исследованы антимикробные препараты для местного применения в стандартных лекарственных формах. Определение антимикробной активности антимикробных препаратовпроводили методом «колодцев» согласно методическим рекомендациям по экспериментальному (доклиническому) изучению лекарственных препаратов для местного лечения гнойных ран (Москва, 1999). В качестве плотной питательной среды использовали агар Мюллера-Хинтона, в котором делали лунки диаметром 8 мм, в которые помещали исследуемые препараты (0,04 г). В качестве опытных тест-культур использовали основные клинические штаммы микроорганизмов (S.aureus, S.epidermidis, P.aeruginisa, Klebsiela pneumonia и грибы родa Candida), выделенных от больных, находившихся на лечении в Ожоговом центре Института хирургии им. А.В.Вишневского в 2008 году. Все штаммы отличались полирезистентностью к большинству антибактериальных препаратов для системного использования. Так, например, штаммы S.aureas (MRSA) были чувствительны только ванкомицину и фузидину, а P.aeruginosa – к карбопенемам и полимиксину. Микробная взвесь суточных культур готовилась по стандарту мутности и соответствовала 105 КОЕ в 1 мл. После засева чашки Петри инкубировали в течение 2 дней при температуре 370С. После чего проводили оценку, критерием которой являлась зона задержки роста микрофлоры: до 10 мм или ее отсутствие – микроорганизмы не чувствительны к препарату; 11-15 мм – обладали малой чувствительностью и более 15 мм чувствительные штаммы (см. рис 1, 2). При этом при зонах задержки роста микроорганизмов до 10 мм фактически можно было говорить о бактериостатическом эффекте, более 10мм - бактерицидном действии. В тоже время даже при отсутствии зоны задержки роста (0 мм) над частью образцов препаратов роста микрофлоры не отмечено, что также говорило об их бактериостатическом действии.
Рис.1
Рис.2
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведено изучение микробиологической эффективности широко применяемых в комбустиологической практике препаратов для местного лечения: растворов - 3% перекиси водорода, 0,02% фурацилина, 1% Йодопирона, 0,01% Мирамистина, 0,05% Хлоргексидина, 0,2% Лавасепта, Октенисепта, пудры Банеоцина, мазей Левомеколь, 5% Диоксидиновая и Фузимет. Раствор гипохлорида натрия 0,12%, который тоже применяется для местного лечения, не изучался в связи с нестойкостью соединения.
Зоны задержки роста микроорганизмов (в мм), полученные при исследовании антимикробных препаратов представлены в табл. 1.
Таблица 1.
Зоны задержки роста микроорганизмов (мм) для антимикробных препаратов
|
S.aureus |
S.epidermidis |
P.aeruginosa |
Klebsiela pneumonia |
Грибы родаCandida |
|
| Контроль 0,9% физ. р-р |
0 |
- |
0 |
0 |
0 |
| Р-р перекиси водорода 3% |
80 |
80 |
62 |
56 |
- |
| Р-р фурацилина |
24 |
23 |
0 |
20 |
- |
| 1% р-р Йодопирона |
13 |
- |
6 |
8 |
18 |
| Р-р 0,01% Мирамистина |
1 |
- |
0* |
0* |
3 |
| Р-р 0,05% Хлоргексидина |
10 |
- |
5 |
5 |
- |
| Р-р 0,2% Лавасепта |
6 |
- |
1 |
3 |
13 |
| Р-р Октенисепта |
3 |
- |
3 |
4 |
8 |
| Пудра Банеоцин |
15 |
- |
10 |
12 |
- |
| Мазь Левомеколь |
8 |
8 |
5 |
7 |
5 |
| Левомицетин*(чистый препарат — 25 мг) |
12 |
12 |
- |
- |
- |
| Мазь Диоксидиновая 5% |
18 |
24 |
15 |
7 |
|
| Мазь Фузимет |
19 |
22 |
- |
- |
- |
«-» — исследование не проводилось; «*» — на образцах роста микрофлоры не отмечено
В ходе исследований показано, что, по-прежнему, сохраняется чувствительность ожоговой микрофлоры к диоксидину и йодофорам, а также банеоцину в виде пудры, содержащей два антибактериальных препарата (бацитрацин и неомицин). Несмотря на длительное широкое применение, сохранялся высокий антимикробный эффект у 3% раствора перекиси водорода, а также раствора фурацилина. При этом раствора перекиси водорода за счет своих свойств был одинаково эффективен в отношении как Гр+, так и Гр-микроорганизмов, а у синегнойной палочки имеется природная устойчивость к фурацилину. Грам-положительные штаммы микроорганизмов были также высоко чувствительны к фузидину. В тоже время широкое использование таких антисептиков, как, мирамистин, хлоргекседин и октенисепт привело к развитию устойчивых к этим препаратам микроорганизмам. Антисептик Октенисепт широко использовался для обработки как ожоговых ран, так и на операции для обработки донорских мест. Несмотря на высокую клиническую эффективность в ряде исследований (Ляпунов Н.А., Минухин В.В., Кривошеин Ю.С. и др., 1993; Пятикоп И.А., 1996; Смирнов С.В., Л.П. Логинов, 2000; Логинов Л.П. с соавт., 2002), раствор мирамистина, по нашим данным, показал самую низкую микробиологическую эффективность, скорее всего связанную с тем, что в ожоговом центре он широко использовался в течение 8 лет (2000-2008 гг.) в основном как препарат при проведениинебулайзерной терапии для профилактики и лечения пневмонии у пострадавших от ожогов. В тоже время его местное применение ограничивалось использованием повязок с мирамистином (Биодеспол-ЛМ, Гелепран, Апполо). Раствор хлоргекседина в чистом виде для лечения ран также не применялся, а входил в состав широко используемых раневых повязок (Активтекс, Бакдиграс, Парапран, Биодеспол-ЛХ).
В последние годы появились сообщения об успешном применении для местного лечения инфицированных ран, в том числе ожоговых, нового антисептика Лавасепт (Гуруков Ш.Р. с соавт., 2000; Воздвиженский С.И. с соавт., 2001). Лавасепт – антисептик для местного применения, содержащий в качестве активного компонента водный раствор бигуанида (полигексонида), представляет собой концентрат во флаконах по 5 мл, который используется только разведенным в виде 0,1% или 0,2% раствора.
В 2003 году в Институте хирургии им. А.В.Вишневского было проведено лабораторное исследование антимикробной активности препарата Лавасепт 0,1% и 0,2% по сравнению с раствором фурацилина (Р.П.Терехова, Л.А.Блатун, 2003) в отношении к госпитальным штаммам микроорганизмов (табл. 2).
Таблица 2.
Сравнение антимикробной активности растворов Лавасепта и Фурацилина
|
Микроорганизмы
|
Зона задержки роста, мм |
||
|
Лавасепт 0,1% |
Лавасепт 0,2% |
Фурацилин |
|
| S.aureus | 15 | 15,4 | 10 |
| S.epedermidis | 17 | 20 | 12 |
| Enterococcus spp. | 13 | 13 | 0,5 |
| E.coli | 13 | 14,4 | 7 |
| P.aeruginosa | 9,4 | 11,8 | 0 |
Полученные данные свидетельствовали о том, что препарат Лавасепт обладал антимикробной активностью как в отношении грамположительных, так и грамотрицательных микроорганизмов. Наиболее высокие показатели наблюдались в отношении S.epidermidis, при этом концентрация препарата особо не имела значения. Немного ниже активность Лавасепта была в отношении S.aureusи Entercoccus spp., но следует отметить, что энтерококки — один из наиболее резистентных видовкокковой флоры, а наиболее часто используемый в практике лечения больных фурацилин не имеет активности в отношении Entercoccus spp. По отношению к грамотрицательной флоре — E.coli, P.aeruginosa препарат «Лавасепт» проявлял несколько меньшую активность, но все-таки и ее нельзя назвать низкой, особенно, если учесть, что P.aeruginosa обладает природной устойчивостью ко многим антимикробным средствам, в том числе к фурацилину. На основании изучения антимикробной активности препарат Лавасепт был рекомендовать для клинических испытаний.
Раствор Лавасепта в максимальной рекомендуемой концентрации 0,2% стал применяться в ожоговом отделении сравнительно недавно — с 2004 года. Препарат использовался как при туалете ран, так и в составе влажновысыхающих повязок.
В тоже время на основании проведенных микробиологических исследований (см. табл. 1) показано, что его широкое использование, также выработало устойчивость к нему у госпитальных штаммов микроорганизмов. Несмотря на это, сохраняется чувствительность к Лавасепту у грибов родаCandida. Для усиления его действия раствор Лавасепта в настоящее время активно используется в качестве акустической среды при проведении ультразвуковой кавитации ожоговых ран (А.А.Алексеев, 2005).
Известно, что влияние повязки на раневой процесс связано как со свойствами носителя, так и свойствами входящих в ее состав лекарственных препаратов. Данное обстоятельство относится и к ихмикробиологической эффективности. В тоже время известно, что эффект антибактериальных препаратов во многом зависит от их концентрации.
Проведено сравнение микробиологической эффективности мазей с антибактериальными препаратами (Левомеколь и диоксидиновая) и чистых препаратов. Так, в 100 г мази Левомеколь согласно прописи входит 0,75 г лемомицетина. Стандартна масса препарата, входящего в лунку чашки Петри - 0,04 г., т.е. она содержала 0,3 мг левомицетина. В работе использовались стандартные диски с левомицетином и диоксидином, в которых концентрация лекарства в несколько десятков раз превосходила их концентрацию в составе мазей. Например, диск с левомицетином содержал 25 мг препарата, в тоже время лунка с мазью левомеколь содержала лишь 0,3 мг левомицетина (меньше в 83,3 раза). В тоже время были получены сравнительно высокие показатели зон задержки роста в обеих случаях. В тоже время, по данным микробиологических исследований 2000 года, если от пострадавших со свежими ожоговыми ранами выделяли штаммы S.aureus и P.aeruginosa, чувствительные к левомицетину в небольшом количестве случаев (9% и 6% случаев соответственно), то за время пребывания в стационаре через 2 недели после травмы раны уже инфицировались госпитальными штаммами микроорганизмов, полностью устойчивыми к левомицетину (А.Э.Бобровников, 2000). Последующие исследования показывают полную устойчивость возбудителей ожоговой инфекции к этому препарату.
Выраженную микробиологическую эффективность для чистого препарата можно объяснить исключительно очень высокой его концентрацией. Известно, что Левомицетин (Хлорамфеникол) угнетая синтез бактериальных белков, является бактериостатиком и только в больших дозах вызывает бактерицидный эффект. В тоже время, эффект мази левомеколь, содержащий небольшую концентрацию левомицетина, скорее всего был связан с высокой антимикробной активностью самой основой данного препарата.
Подобный микробиологический эффект наблюдался и при исследовании 5% диоксидиновой мази, которая 100 г содержала 5 г диоксидина с мази, соответственно в лунку чашки Петри входило 2 мг препарата.
Таким образом, сравнительно высокая микробиологическая эффективность мазей Левомеколь и диоксидиновой, несмотря на их длительное и широкое применение, а также наличие резистентности микрофлоры в левомицетину и диоксидину, входящих в их состав, скорее всего связаны с антимикробной активностью самой гидрофильной полиэтиленгликолевой основой данных препаратов.
Вызывает интерес определение микробиологической эффективности некоторых современных раневых повязок, тем более многие из них содержат в своем составе антимикробные препараты. Были исследованы атравматичные повязки Бранолинд, пленочные повязки Биодеспол, текстильные повязки Активтекс и биологические повязки Ксенодерм (см. табл. 3)
Таблица 3.
Зоны задержки роста микроорганизмов (мм) при использовании раневых повязок.
|
ПРЕПАРАТ |
Микроорганизмы (госпитальные штаммы) |
||
|
S.aureus |
P.aeruginosa |
Klebsiela pneumonia |
|
| Повязка Бранолинд Н |
0* |
0* |
0* |
| Повязка Ксенодерм |
0* |
0* |
0* |
| Повязка Биодепол(с лидокаином и мирамистином) |
2 |
2 |
2 |
| Р-р 0,01% Мирамистина |
1 |
0* |
0* |
| Повязка Активтекс(с лидокаином и хлоргексидином) |
11 |
3 |
5 |
| Р-р 0,05% Хлоргексидина |
10 |
5 |
5 |
* На образцах роста микрофлоры не отмечено — бактериостатическое действие.
На основе проведенных in vitro исследований получены следующие данные. Для повязок Бранолинд, не содержащих в своем составе антибактериальных препаратов, несмотря на то, что по некоторым данным за счет входящего в их состав пируанского бальзама они могут обладать небольшой бактерицидной активностью, зон задержки роста микроорганизмов не было отмечено. Подобная картина наблюдалась и при исследовании покрытия Ксенодерм. В тоже время изучение повязок Активтекс и Биодеспол, содержащих антимикробные препараты, показало их микробиологическую эффективность в отношении возбудителей ожоговой инфекции. При этом эффективность как чистого препарата хлоргекседина, так и в составе повязок Активтекс была практически одинаковой. В тоже время повязки Биодеспол за счет своей основы (сополимера лактида с гликолидом и поливинилового спирта) показали даже большую эффективность по сравнению с раствором мирамистина.
В связи с тем, что патогенная микробная флора в ранах очень быстро приобретает устойчивость к антибактериальным препаратам, большой интерес вызывает наличие на современном рынке средств, обладающих антисептическим действием и в тоже время не имеющих в своем составе антибиотиков и сульфаниламидов. Одним из таких препаратов является раствор Ацербин, содержащий в качестве активных компонентов небольшие концентрации салициловой, бензойной и яблочной кислот на гидрофильной основе.
По-прежнему, в клинической практике лечения ран находят применение препараты, созданные на основе растительного сырья. Одним из них является Бальзам Залевского, содержащий масла микроводоросли Спирулины и сибирского кедра.
Было проведено изучение микробиологической эффективности препаратов Ацербин и Бальзам Залевского (см. табл. 4).
Таблица 4.
Зоны задержки роста микроорганизмов (мм) при использовании
препаратов Ацербин и Бальзам Залевского.
|
ПРЕПАРАТ |
Микроорганизмы (госпитальные штаммы) |
|||
|
S.aureus |
P.aeruginosa |
Klebsiela pneumonia |
Грибы родаCandida |
|
| Контроль 0,9% физ. р-р |
0 |
0 |
0 |
0 |
| Р-р Ацербин |
8 |
5 |
4 |
7 |
| Бальзам Залевского |
10 |
0 |
4 |
2 |
Полученные данные показали их умеренную эффективность в отношении основных возбудителей ожоговой инфекции, что определило возможность их использования для лечения инфекции ожоговых ран. При этом, препарат Ацербин за счет действия кислот был почти одинаково эффективен в отношении как Гр+ и Гр-микрофлоры, так и грибов. В тоже время Бальзам Залевскогобыл особенно эффективен в отношении штаммов S.aureus (следует заметить, что это были штаммыMRSA). Подобная антибактериальная активность в отношении антибиотикоустойчивых стафилококков, по данным литературы, наблюдается также для растительного препарата Хлорофиллипта (эвкалипта шарикового листьев экстракт) (Клюев М.А., 2001).
В настоящее время поистине второе рождение приобретают препараты с серебром, которое, по данным разных авторов (Klasen, H. J. 2000; Lansdown, A. B., 2002), обладает широкими антимикробными, противогрибковыми и противовирусными свойствами.
Во всем мире широкое распространение при лечении обожженных получили мази (кремы) на основе сульфадиазина (сульфатиазола) серебра (см. рис. 2), которые выпускаются под различными названиями («Сильваден», «Фламазин», «Дермазин», «Эбермин». «Аргосульфан» и др.), также обладающие, по данным инструкций к их применению, широким спектром антимикробного действия. Обычно в качестве носителя для препаратов серебра приходится использовать вторичную марлевую повязку. При этом понятно, что лечебный эффект реализуется как за счет свойств препаратов, так и действия самой марли. Учитывая данные обстоятельства, были созданы комбинированные серебросодержащие повязки (Acticoat, Cellosorb Ag, Actisorb silver, SilverCell, Urgotul S.Ag и др.). Лечебный эффект указанных повязок реализуется на практике за счет их атравматичных и дренирующих свойств, способности поддерживать влажную раневую среду, необходимую для оптимального заживления и проявления антимикробных свойств серебра. Медленное высвобождение серебра из таких повязок гарантирует их эффективность в течение длительного времени. А входящее в состав современных повязок Acticoat нанокристалическое серебро отличается от обычного серебра значительно большей площадью поверхности, быстрее высвобождает свои ионы и, следовательно, может иметь более высокий уровень антибактериальной активности.
Было проведено микробиологическое исследование эффективности современных серебросодержащих кремов и повязок, которые содержали как ионы серебра, так и металлическое серебро (см. табл. 5).
Таблица 5.
Зоны задержки роста микроорганизмов (мм) при использовании
серебросодержащих препаратов.
|
ПРЕПАРАТ |
Штаммы |
|
|
S.aureus |
P.aeruginosa |
|
| Крем Агросульфан с сульфатиазолом серебра |
3 |
2 |
| Крем Эбермин с сульфадиазином серебра |
4 |
4 |
| Повязка Urgotul без лекарственных препаратов |
0 |
0 |
| Повязка Cellosorb Ag с сульфатом серебра |
1 |
1 |
| Повязка Urgotul S.Ag с кремом сульфадиазина серебра |
2 |
2 |
| Повязка Acticoat с нанокристаллическим серебром |
4 |
3 |
Полученные данные показали, что к серебросодержащим кремам отмечено формирование устойчивости у госпитальных штаммов микроорганизмов. Подобная картина наблюдалась и при изучении современных повязок с серебром. Отсутствие зон задержки у атравматичной повязки Urgotulбез лекарственных препаратов позволяет говорить о том, что именно за счет входящих препаратов серебра, проявлялась антимикробная активность данных повязок. При этом, нанокристаллического серебра в составе повязок несколько повышало их антибактериальный эффект. Однако, следует заметить, что в клинической практике средства с серебром используются в течение уже длительного времени, постоянно и очень широко. В тоже время сохраняющаяся их антимикробная активность позволяет эффективно их использовать в качестве местных средств, особенно для профилактики инфекции.
ЗАКЛЮЧЕНИЕ
На основе проведенных исследований можно сделать некоторые практические выводы.
- Во-первых, и самое главное, это соответствие антибактериального спектра действия препарата чувствительности к нему микрофлоры. Поэтому, выбор антибактериальных средств для местного лечения необходимо осуществлять только в соответствии с характером чувствительности выделяемой из ожоговых ран микрофлоры к применяемым препаратам или с учетом возможных микроорганизмов, возбудителей ожоговой инфекции в конкретном стационаре. В тоже время, изучение динамики микрофлоры и ее чувствительности к антибактериальным препаратам важно как для выработки стратегии и тактики применения местной антибактериальной терапии, так и для планирования санитарно-эпидемиологических мероприятий по борьбе с госпитальной инфекцией в каждом отдельном стационаре.
- Во-вторых, серьезной проблемой является рост резистентности возбудителей инфекции к антибактериальным препаратам. В случаях появления резистентности госпитальных штаммов микроорганизмов к местным антимикробным препаратам целесообразно прекратить их использование на некоторое время для восстановления к ним чувствительности.
- В-третьих, эффективность зависит как от дозы препарата, так и времени контакта и проникновения вглубь раны. Поэтому необходимо использовать только эффективные концентрации антимикробных средств, при этом требуется проведение дополнительных исследований как для определения их переносимости в отношении всего организма, так и проявлений местной цитотоксичности. Для осуществления местного антимикробного действия препаратам также нужно определенное время. Полученные в ходе исследования данные позволили выделить препараты, которые обладали выраженной бактерицидной активностью (3% р-р перекиси водорода и 0,02% р-р фурацилина), поэтому более рационально использоватьэти растворы, а также возможно, гипохлорит натрия, на перевязках для туалета ран (кратковременной обработки), что обычно и делается на практике. В тоже время низкие зоны задержки роста микроорганизмов для других средств диктуют необходимость более длительного контакта препаратов с микрофлорой для проявления их бактерицидной, а в основном – бактериостатической, активности, в связи с чем лучше применять эти препараты в составе раневых повязок (длительное действие).
- В-четвертых, рационально использование для местного лечения ожоговых ран повязок с антимикробными препаратами. При использовании перевязочных средств, не обладающих антимикробными свойствами, желательно комбинировать их с антибактериальными и противогрибковыми средствами.
- В-пятых, возможно применение дополнительных методов воздействия на ожоговуюинфекцию, в том числе физических, а также использование других альтернативных средств.
Ограниченный материал исследований не позволяет говорить о преимуществах каждого из исследованных препаратов. Кроме этого, даже, несмотря на небольшую антимикробную эффективность, полученную in vitro, на практике многие из них показывают хорошую клиническую эффективность при лечении обожженных (Bellinger GC, Conway H. 1970; Maggi SP et all., 1999; Argamaso RV, Garcia A, Freiman M, et all. 1970; Kucan JO, Smoot EC. 1993; Mendelson JA. 1997; Boyce ST et all., 1999; Kramer SA. 1999; Heggers JP, Sazy JA, Stenberg BD, et all. 1991; Cotter JL et all., 1985; Смирнов С.В., Л.П. Логинов, 2000; Алексеев А.А. с соавт., 2006 и др.).
Суммируя вышеизложенное, ниже представлены современные наиболее эффективные в комбустиологической практике антимикробные препараты для местного применения, которые можно использовать как для непосредственной обработки ран, так и в составе влажновысыхающих повязок, мазей или раневых покрытий:
- Перекись водорода 3%
- Фурацилин
- Сульфадиазин (сульфатиазол) серебра
- Фузидин
- Хлоргексидин
- Повидон йод (йодопирон)
- Лавасепт
- Диоксидин
- Левомицетин (в составе мазей левомеколь, левосин)
- Банеоцин (neomycin + polymyxin В)
- Гипохлорит натрия
ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Argamaso RV, Garcia A, Freiman M, et al. Effect of Sulfamylon acetate on wound healing. Plast Reconstr Surg 1970;46:282–6.
2. Bellinger GC, Conway H. Effects of silver nitrate and Sulfamylon on epithelial regeneration. Plast Reconstr Surg 1970;45:585.
3. Boyce ST, Supp AP, Swope VB, Warden GD. Topical Sulfamylon reduces engraftment of cultured skin substitutes on athymic mice. J Burn Care Rehab 1999;20:33–6.
4. Cotter JL, Fader RC, Lilley C, Herndon DN. Chemical parameters, antiseptic activities, and tissue toxicity of 0.1 and 0.5% sodium hypochlorite solutions. Antimicrob Agents Chemother 1985;28:118–22.
5. Goodwin C.W., Yurt R.W. Epidemiology of burn wounds. In: Galling J.I., Fauci A.S. (Eds): Advances in host defence mechanisms. Raven Press.-New York, 1986.-Vol.,6.- P. 5-18.
6. Heggers JP, Sazy JA, Stenberg BD, et al. Bactericidal and wound-healing properties of sodium hypochlorite solutions: The 1991 Lindeberg Award. J Burn Care Rehab 1991;12:420–4.
7. Klasen, H. J. Historical review of the use of silver in the treatment of burns. I. Early uses. Burns, 2000, 26, 117–130.
8. Kramer SA. Effect of povidone-iodine on wound healing: A review. J Vasc Nursing 1999;17:17–23.
9. Kucan JO, Smoot EC. Five percent mafenide acetate solution in the treatment of thermal injuries. J Burn Care Rehab 1993:144;158-163.
10. Lansdown, A. B. Silver. 1. Its antibacterial properties and mechanism of action. J Wound Care, 2002, 11, 125–130.
11. Mackie D.P., Van Hertum W.A.J., Schumburg T. et all. Prevention of infection in burns. J. Travma.-1992.-N32,5.- P. 570-575.
12. Maggi SP, Soler PM, Smith PD, Hill DP, Ko F, Robson MC. The efficacy of 5% Sulfamylon solution for the treatment of contaminated explanted human meshed skin grafts. Burns 1999;25:237–41.
13. Mendelson JA. The management of burns under conditions of limited resources using topical aqueous Sulfamylon (mafenide) hydrochloride spray. J Burn Care Rehab 1997; 18: 238–44.
14. Polk H.C. Consensus summary on infection//J. Trauma. – 1979. – Vol. 19, N 11. – P.894-896.
15. Pruitt B.A., McManus A.T., Kim S.H. Burn wound infections: current status. World J Surg 1998; 22(2): 135-45.
16. Азолов В. В., Жегалов В. А., Перетягин С. П. Состояние и перспективы развития комбустиологии в России. Научно-практический журнал «Комбустиология» //Печатный орган Секции термических поражений Ассоциации Хирургов им. Н. И. Пирогова. 1999, N1.
17. Алексеев А.А, Бобровников А.Э., Крутиков М.Г., Тусинова С.А., Кашин Ю.Д., Лагвилава М.Г. Опыт применения полигексанида для местного лечения инфицированных ожоговых ран, Хирургия, приложение к журналу Consilium medicum, 2006, №1, 55-58.
18. Алексеев А.А. Ожоговый сепсис: диагностика, профилактика, лечение // Дис.доктора мед. наук., Москва, 1993.
19. Алексеев А.А. Проблемы и успехи лечения тяжелообожженных //VII Всероссийская научно-практическая конференция по проблеме термических поражений. Тез.докл. — Челябинск, 1999. — С.6-8.
20. Алексеев А.А., Бобровников А.Э., Попов С.В.Современные технологии хирургического лечения пострадавших от ожогов. Материалы конференции «Современные вопросы лечения термических поражений и их последствий», г.Донецк, Украина, 2005, с.114-116.
21. Бобровников А.Э. Антибиотикопрофилактика послеоперационных инфекционных осложнений в комбустиологии: Дис…канд. мед. наук., Москва, 2000. — 260.
22. Вихриев Б.С., Бурмистров В.М., Ожоги (Руководство для врачей). 2-е изд., перераб. и доп. — Л., Медицина, 1986.
23. Воздвиженский С.И., Будкевич Л.И., Гуруков Ш.Р. Современные антисептики и антибактериальные препараты в местном лечении ожогов у детей//Научная конференция «Актуальные проблемы травматологии и ортопедии»: Тез. докл. — Нижний Новгород, 2001. — С.157-158.
24. Гуруков Ш.Р., Пеньков Л.Ю., Чернова Л.И. и др. Применение нового антисептика «Лавасепт» в лечении детей с термической травмой//Конгресс «Комбустиология на рубеже веков»: Тез. докл. — М., 2000. — С.119.
25. Клюев М.А. Справочник «Лекарственные средства», 2001.
26. Кузин М.И., Сологуб В.К., Юденич В.В., Ожоговая болезнь. М., Медицина, 1982, 160.
27. Логинов Л.П., Кривошеин Ю.С., Шахламов М.В. Местное лечение обожженных отечественным антисептиком мирамистин//Международная конференция, посвящкнная 70-летию НИИ скорой помощи им. И.И.Джанелидзе и 55-летию ожогового центра «Актуальные проблемы термической травмы»: Тез.докл. — СПб., 2002. — С.282-283.
28. Ляпунов Н.А., Минухин В.В., Кривошеин Ю.С. и др. Экспериментальное исследование антибактериальных и фунгицидных препаратов мази и аэрозоля мирамистина. Харьков, 1993.
29. Пятикоп И.А. Разработка метода наружной терапии больных микозами кожи с использованием комбинированных мазей на гидрофильной основе, содержащей мирамистин. Автореф. дис. … канд. мед. наук. Харьков, 1996.
30. Смирнов С.В., Л.П. Логинов. Результаты лечения ожоговых ран с использованием отечественного антисептика мирамистина. В мат. симпоз. “Мирамистин — новый отечественный антисептик широкого спектра действия”. М., 2000, с.17
31. Терехова Р.П., Блатун Л.А. Отчет о результатах лабораторного исследования антимикробной активности препарата Лавасепт 0,1% и 0,2%, № 048/p-302, 2003
Designed by Сайт на Заказ