ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Морфогенез ожоговых ран на основе применения остеонекрэктомии, остеотрепнации и остеотрепанации с трансплантацией аллофибробластов
Подурец Д.П.
Фисталь Н.Н.
Постолюк И.Г.
Институт неотложной и восстановительной хирургии
им. В.К.Гусака АМН Украины, Донецк.
Донецкий государственный медицинский университет им. М. Горького, Украина
Реферат: Работа посвящена изучению динамики процесса репарации глубоких ожоговых ран с использованием современных общегистологических, гистохимических и иммуногистохимических методик исследования у больных с субфасциальными ожогами и обнажением костей голени.
Ключевые слова: глубокий ожог, ранняя некрэктомия, остеотрепанация, культура фетальных аллофибробластов.
Проблема ожогов на современном этапе является очень актуальной в связи с ростом производства, развитием транспортных средств, усилением урбанизации населения, кроме того, увеличением природных катаклизмов [6]. Ожоговая травма является одной из самых распространённых травматических повреждений в мире. Ежеминутно в мире один человек становится жертвой ожогов со всеми вытекающими отсюда последствиями. В Украине от ожогов ежегодно страдает около 100 тысяч человек [7]. Термические поражения представляют собой серьёзную медицинскую, социальную и экономическую проблему, занимают третье место в структуре общего травматизма среди травм мирного времени [5], при этом нижние конечности страдают чаще всего. Достигнутое в последнее время снижение летальности в начальных стадиях ожоговой болезни мало отразилось на судьбе больных с глубокими обширными поражениями. Теперь они часто погибают не в первые дни, а в последующем, в стадии септикотоксэмии, от развития необратимых изменений в организме [1]. Успешное лечение ожоговых ран, локализующихся на нижних конечностях, является определяющим моментом в предупреждении тяжких последствий, поскольку утрата способности к перемещению означает инвалидность [3,4,9]. Удельный вес больных с глубокими циркулярными ожогами голеней составляет около 0,9% от общего числа обожжённых, но при этом отмечается высокий уровень выхода на инвалидность – 46,15% [10]. Причинами неудовлетворительных функциональных результатов лечения этой патологии является близость к коже мыщелков, лодыжек, гребня большеберцовой кости, что приводит к их первичному поражению при травме, повреждение глубоких анатомических структур, а развивающиеся нарушения кровообращения и воспалительный процесс – к развитию осложнений и грубых деформаций [8,10].
Цель работы – изучить морфогенез глубоких ожоговых ран в результате проведения ранней остеонекрэктомии, остеотрепанации и остеотрепанации в сочетании с трансплантацией аллофибробластов с использованием современных общегистологических, гистохимических и иммуногистохимических методик исследования для улучшения результатов лечения больных с субфасциальными ожогами и обнажением костей голени.
Материал и методы.
В отделе термических поражений и пластической хирургии ИНВХ им. В.К.Гусака АМН Украины (Донецк), у больных с субфасциальными ожогами и обнажением костей голени разработан и внедрён, способ лечения последствий ожогов IV степени голени и стопы (патент Украины № 55036А, опубликован в бюл. №3 от 17.03.03.).Способ заключается в проведении фрезевой остеотрепанации обнажённых, или повреждённых ожогом костей и в результате – лишённых надкостницы, в ранние сроки после травмы (до развития инфекционных осложнений). Сплошной рост грануляций обеспечивается наложением на обнажённую кость множественных фрезевых отверстий. При этом мы отдаём предпочтение медицинской электрической дрели с регулируемой скоростью вращения фрезы, из-за меньшей травматизации костного мозга и самой кости. На голени производили трепанацию по передневнутренней поверхности большеберцовой кости, нанося трепанационные отверстия на расстоянии 1 см друг от друга, диаметром 8-10 мм. Это вызывает разрастание грануляционной ткани из костного мозга и создаёт условия для приживления аутотрансплантатов кожи, появляющиеся грануляции способствуют отторжению оставшихся фрагментов некротизированных тканей и постепенно покрывают кость. Разрастание грануляционной ткани создаёт условия для выполнения свободной аутодермопластики.
Для стимуляции роста грануляций и приживления аутотрансплантатов используем культуру фетальных аллофибробластов. Известно, что фибробласты, подобно мононуклеарным иммуноцитам, способны продуцировать провоспалительные цитокины — ИЛ-1, ФНО, ИЛ-8, колоние-стимулирующие факторы, а также многочисленные факторы роста клеток [12], среди которых можно выделить факторы, стимулирующие рост кератиноцитов, регулюрующие процесс костеобразования, влияющие на неоангиогенез [11].
Предметом изучения послужили биоптаты грануляционной ткани из ожоговых ран при глубоких ожогах III-IV степени голеней в процессе репарации у 18 больных. Для изучения репарации ожоговых ран, в зависимости от применяемой тактики лечения нами была произведена вI группе больных остеонекрэктомия большеберцовой кости (6 больных), во II-й группе остеотрепанация большеберцовой кости (6 больных) и вIII-й группе – выполнена трансплантация культуры фетальных аллофибробластов на остеотрепанационные отверстия (6 больных). Больные всех трёх групп были одинаковыми по срокам, площади и глубине повреждениями и обнажением гребня большеберцовой кости.
Кусочки грануляционной ткани из ран (все биопсии проведены с согласия больных, взяты по медицинским показаниям при проведении оперативного лечения – некрэктомия, аутодермопластика), фиксировали в нейтральном забуференном формалине (pH 7,4) в течение 24 часов. После дегидратации кусочки заливали в парафин по стандартной методике. На ротационном микротоме Microm HM325 с системой переноса срезов STS (Carl Zeiss, Германия) изготавливали серийные гистологические срезы толщиной 5 мкм, которые затем окрашивали гематоксилином и эозином, по ван Гизону, по Вергофу, толуидиновым синим при рН 2,6 и 5,3, ставили ШИК-реакцию с обработкой контрольных срезов амилазой.
Часть серийных гистологических срезов помещали на покрытые адгезивом стекла Super Frost Plus (Menzel, Германия) для иммуногистохимического исследования. Для «демаскирования» антигенов регидратированные срезы подвергали термической обработке в растворе Target Retrieval Solution (DAKO, Дания) с использованием водяной выпарной бани GFL 1023. После блокирования неспецифического связывания белков протеиновым блоком (DAKO) и эндогенной пероксидазной активности пероксидазным блоком (DAKO) наносили первичные антитела. Для выявления фибробластов использовали мышиные моноклональные антитела (МАТ) к виментину (клон Vim 3V4, DAKO), актину (клон HHF35, DAKO), для типирования клеток инфильтратов использовали МАТ к CD4 (Т-хелперы) (клон 1F6,Novocastra), CD8 (Т-супрессоры) (клон 1A5, Novocastra), CD68 (макрофаги) (клон PG-M1, DAKO). Визуализацию первичных антител проводили с помощью полимерной системы детекции DAKO En Vision+. В качестве субстрата для пероксидазы хрена использовали DAB+ (DAKO). Препараты докрашивали гематоксилином Майера. Далее окрашенные срезы заключали в полусинтетическую среду PermanentMounting Medium (DAKO).
Микроскопию препаратов проводили на микроскопе Olympus AX70Provis (Olympus, Япония) с помощью программы анализа изображенияAnalysis 3.2 Pro (Soft Imaging, Германия) согласно рекомендациям производителя программного обеспечения.
Результаты и обсуждение.
В первой группе к 10 суткам после остеонекрэктомии большеберцовой кости и комплексного местного лечения в поверхностных отделах раны сохраняется достаточно широкий и плотный лейкоцитарно-некротический слой, содержащий лизированные клетки местной ткани и пласты фибрина. Несмотря на выраженную перифокальную сосудистую реакцию, в поверхностных отделах в просветах сосудов содержатся преимущественно эритроциты и единичные лейкоциты. Лейкодиапедез в этот период выражен слабо. Большинство нейтрофильных полиморфноядерных лейкоцитов (ПЯЛ) лейкоцитарно-некротического слоя находятся в состоянии лейкоклазии.
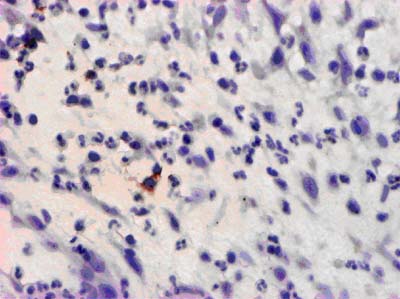
При исследовании более глубоких слоев раны в этот срок отмечается формирование выраженной воспалительной инфильтрации. Инфильтрат представлен преимущественно сегментироваными нейтрофильными элементами с примесью незначительного количества лимфоцитов и макрофагов (рис. 1).
Рисунок 1. Ожоговая рана голени. 10-е сутки после проведения ранней остеонекрэктомии. Единичные лимфоциты Т-хелперы в составе клеточного инфильтрата в глубоких отделах раны. ИГХ с МАТ к CD4, х 300.
К 14 суткам после проведения остеонекрэктомии и начала местного лечения нейтрофильная инфильтрация стабилизируется, имеет место увеличение числа макрофагов и молодых фибробластических элементов. В этот период происходит формирование грануляционной ткани. Стенка новообразованных сосудов утолщена, отечна, пропитана плазмой крови, ШИК-позитивная. На отдельных участках выявляется тромбоз отдельных микрососудов с перифокальным нерезко выраженным отеком. Несмотря на то, что удельный объем смешанной нейтрофильно-мононуклеарной инфильтрации значительно возрастает к концу 14 суток от начала лечения, число активно фагоцитирующих клеток, включающих ПЯЛ с сохранившейся цитологической структурой, а также макрофагов, положительно типируемых МАТ к антигену CD68, выявляется в небольшом количестве.
Плотность распределения активно фагоцитирующих клеток в поверхностных слоях раны к 10 суткам была минимальной. Удельный объем активно фагоцитирующих микро- и макрофагов в гнойно-септической ожоговой ране без проведения остеотрепанации нарастает постепенно и достигает максимума на 18 сутки лечения. В дальнейшем число активно фагоцитирующих макрофагов уменьшается и параллельно наблюдается пролиферация фибробластов.
Макрофагально-фибробластические также как и фибробластно-сосудистые взаимоотношения в биоптатах данной группы пациентов нарушены.
На 21 сутки после проведения остеонекрэктомии в участках созревания грануляционной ткани нами отмечено несоответствие между достаточно высоким удельным объемом сосудов, а также фибробластов и формированием коллагеновых волокон (рис. 2). В таких участках коллагеновые волокна были слабо ШИК-позитивны, преимущественно пикринофильны при окраске по ван Гизон.
Рисунок 2. Ожоговая рана голени. 21-е сутки после проведения остеонекрэктомии. Участок созревающей грануляционной ткани. ИГХ с МАТ к виментину, х95.
Одной из важных особенностей процесса репарации в данной группе на 21 сутки является то, что у большинства больных в ране чередуются участки с рыхлой волокнистой и плотной (фиброзной) соединительной тканью, разделенные инфильтратами из лимфоидных и единичных плазматических клеток.
Выраженный полиморфизм капилляров свидетельствует о негармоничном развитии репаративной реакции и нарушении регуляции репаративных процессов.
Во II группе больных с репарацией ожоговых ран при комплексном лечении с проведением остеотрепанации большеберцовой кости,результаты микроскопического исследования показали, что у всех больных к моменту проведения операции остеотрепанации в ране было выраженное гнойное воспаление. Нами отмечены характерные для данного этапа течения ожоговой болезни морфологические изменения в биоптатах из ожоговых ран.
Некротический пласт, как правило, был гомогенным и слабо базофильным, внутренние слои содержали окрашенные в розовые тона зернистые массы, что свидетельствовало о наличии в его составе фибрина. В преобладающей части наблюдений было отмечено гнойное воспаление и инфильтрация подлежащих отделов дермы и жировой клетчатки в краях раны.
В клеточном составе воспалительного инфильтрата на границе с поверхностным лейкоцитарно-некротическим слоем доминирующим клеточным пулом были нейтрофильные ПЯЛ, отличающиеся высокой секреторной активностью. Местами такие ПЯЛ без выраженных признаков лейкоклазии формировали микроабсцессы, что свидетельствовало об их выраженной протеолитической активности. В ряде случаев они располагались диффузно, по типу флегмонозных участков, по периферии которых в просвете сосудов микрогемоциркуляторного русла (МГЦР) выявлялись конглютинационные и агглютинационные обтурирующие тромбы, что, по нашему мнению, способствовало формированию микронекрозов и дальнейшему распространению воспалительного процесса.
Под некротическим пластом в отдельных случаях начинала формироваться грануляционная ткань. Она была представлена расширенными, неправильной формы, фестончатыми капиллярами синусоидного типа с неравномерным кровенаполнением, диаметр которых существенно превышал диаметр обычного капилляра.
Во второй группе после выполнения остеотрепанации большеберцовой кости при гистологическом изучении биоптатов уже к началу 10-х суток были отмечены морфологические признаки стихания воспалительного и начала репаративно-резорбтивных процессов в ране. Вместе с тем, несмотря на значительное уменьшение количества ПМЯЛ, вокруг отдельных сосудов выявляются лейкоцитарные муфты, свидетельствующие о сохранении лейкоцитарной активности.
К 14-м суткам после проведения остеотрепанации в ране в области остеотрепанационных отверстий определялась грануляционная ткань ярко-розового цвета с тонким налетом фибрина на поверхности. При микроскопическом исследовании биоптатов в поверхностных и в глубоких слоях раны к этому сроку наблюдается пролиферация эндотелиальных клеток, которые формируют сосудистые почки. Из этих почек в дальнейшем происходит дифференцировка МГЦР грануляционной ткани.
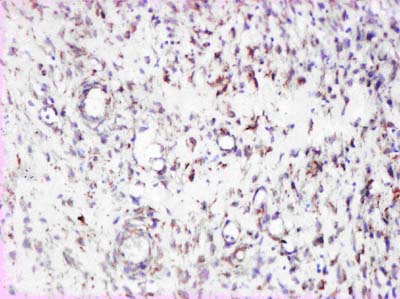
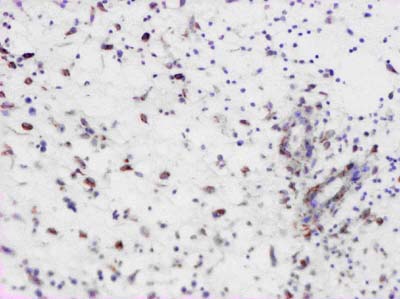
В этот период в пограничных участках раны интра- и периваскулярно выявляются в большом количестве ПЯЛ с хорошо сохранившейся цитологической структурой (практически без признаков лейкоклазии). Кроме того, при помощи МАТ к антигену CD68 мы выявляли активно фагоцитирующие клетки макрофагального ряда. Плотность распределения указанных клеточных элементов в поверхностных слоях раны нарастала до 14 суток после проведения остеотрепанации, и к началу 18 суток по результатам морфометрического исследования удельный объем активно фагоцитирующих клеток был максимальным (рис. 3). Увеличение числа активно фагоцитирующих клеток во временном аспекте совпадает с пролиферацией эндотелиальных клеток и формированием сосудов грануляционной ткани.
Рисунок 3. Ожоговая рана голени на 18 день после проведения остеотрепанации. Активно фагоцитирующие макрофаги и НПЯЛ в составе воспалительного инфильтрата, в цитоплазме которых выявляется антиген CD68. ИГХ с МАТ к CD68, х150.
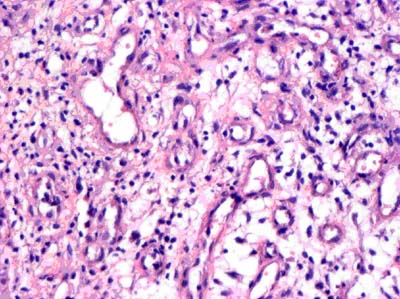
Новообразование капиллярных почек и сосудистых петель в поверхностных слоях раны отмечается уже к концу 14 суток после проведения остеотрепанации. Интенсивность их формирования в первые 14 суток совпадает с интенсивностью нарастания плотности фагоцитирующих микро- и макрофагов. В МГЦР формирующейся грануляционной ткани отмечается стаз, умеренная эктазия просвета капилляров, повышенная проницаемость сосудов, усиленный выход из сосудистого русла лейкоцитов и плазмы (рис.4). К особенностям формирования грануляционной ткани из остеотрепанационных отверстий следует отнести тот факт, что уже на 14 сутки периваскулярно наряду с макрофагами выявляются фибробластические элементы различной степени дифференцировки – от эпителиоидных до фибробластов с морфологическими признаками высокой функциональной активности.
Рисунок 4. Грануляционная ткань из остеотрепанационных отверстий на 14 сутки после проведения остеотрепанации. Умеренная эктазия просвета капилляров, высокая плотность распределения лейкоцитов и выход плазмы крови вследствие повышенной проницаемости стенки сосудов. Окраска гематоксилином и эозином, х 120.
В таких участках выявляется фибриллярная аргентофильная сеть и извитые тонкие пучки преколлагеновых волокон. Такие волоконца слабофуксинофильны, умеренно ШИК-позитивны. Перифибриллярная клеточная реакция слабо выражена. Встречаются единичные тканевые базофилы, лимфоциты и плазматические клетки. Полиморфноядерные нейтрофилы практически отсутствуют. Описанные выше микроскопические изменения свидетельствуют о благоприятной репаративной динамике.
На 18 сутки происходит дальнейшая активная репаративная трансформация клеточных и тканевых компонентов раны. Наблюдается дальнейшее увеличение удельного объема фагоцитирующих микро- и макрофагов, сохраняется новообразование капиллярных почек и сосудистых петель как в поверхностных, так и в более глубоких отделах раны.
Высокий удельный объем сосудов МГЦР обеспечивает достаточный уровень оксигенации, нормализации гомеостаза, ускоренное очищение гнойно-септической раны от тканевого и клеточного детрита, пролиферацию фибробластов, процесс фибриллообразования, созревания коллагеновых волокон в ране, и в конечном счете, формирование мягкого, эластичного рубца.
На 21 сутки практически у всех пациентов данной группы в ране наблюдается равномерное формирование рыхлой, местами плотной волокнистой соединительной ткани. Стенка новообразованных сосудов тонкая, представлена эндотелием, расположенным на базальной мембране. Такие сосуды обеспечивают достаточно высокий уровень транскапиллярного транспорта. Клеточная воспалительная реакция практически отсутствует. Сохраняются мелкие лимфо-гистиоцитарные группы клеток.
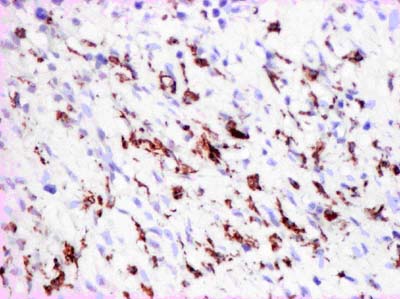
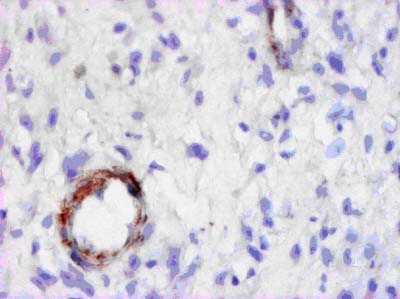
Эта новообразованная соединительная ткань достаточно хорошо васкуляризирована. Периваскулярно при иммуногистохимическом исследовании нами выявлено образование перицитов, содержащих в цитоплазме промежуточные филаменты актина и виментина (рис. 5). В рядом расположенных фибробластах также выявлены аналогичные промежуточные филаменты, то есть, эти клетки имеют строение, характерное для миофибробластов. Это дает нам основание предположить, что в новообразованной ткани происходит трансформация перицитов в миофибробласты, обеспечивающие при ее дальнейшей дифференцировке достаточную эластичность.
Рисунок 5. Периваскулярная пролиферация перицитов в ожоговой ране на 21 сутки после проведения остеотрепанации. ИГХ с МАТ к актину, х225.
В третьей подгруппе больных (6 наблюдений), которым по клиническим и морфологическим показаниям в ходе комплексного лечения выполнялась остеотрепанация. На остеотрепанационные отверстия трансплантировали культуру фетальных аллофибробластов, при микроскопическом исследовании биоптатов грануляционной ткани была отмечена положительная динамика уменьшения степени воспаления и усиления процесса репарации, аналогичная описанной нами в группе больных с проведением остеотрепанации. Однако темп стихания воспалительного и начала репаративно-резорбтивных процессов в ожоговых ранах у этого контингента больных после применения культуры фетальных аллофибробластов был несколько выше, чем у больных предыдущей исследовательской группы. Вероятно, это связано с тем, что использование культуры аллогенных фибробластов выполняет по крайней мере два важнейших действия — во-первых, как временное биологическое покрытие защищает рану от высыхания, создает оптимальные условия для роста грануляций, во-вторых, со стороны фибробластов оказывается мощнейший стимулирующий эффект посредством выделения биологически активных веществ и факторов роста [2,13].
Динамика морфологических характеристик воспалительного и репаративного процессов в ожоговых ранах в группе больных, у которых применялась культура аллофибробластов, не отличалась от таковой в группе больных с проведением остеотрепанации большеберцовой кости. Отличия наблюдались лишь в сроках формирования и созревания грануляционной ткани, а как следствие укорочение сроков до проведения аутодермопластики. Трансплантацию культуры аллогенных фибробластов на рану проводили одновременно с проведением остеотрепанации большеберцовой кости.
Начиная с 7-х суток после проведения остеотрепанации с применением культуры аллофибробластов, практически во всех гистологических препаратах наблюдается значительное уменьшение ПМЯЛ во всех структурах, а к 10-м суткам отсутствуют морфологические признаки появления в ране новых порций выселившихся лейкоцитов: не отмечен лейкодиапедез, не выявлялись также сохранные лейкоциты или с начальными явлениями распада. К 10-м суткам у всех исследуемых больных этой группы лейкоцитарная инфильтрация во всех слоях раны была значительно ниже, чем в обеих предыдущих исследовательских группах.
Очень важным прогностическим признаком, свидетельствующем о прогрессировании процессов репарации, является начало пролиферации фибробластических элементов, сначала периваскулярно, а затем и на границе с трансплантированной культурой фибробластов, обнаруживаемое уже на 10 стуки после ее применения (рис. 6).
Рисунок 6. Периваскулярная пролиферация перицитов в ожоговой ране на 10 сутки после проведения остеотрепанации в сочетании с культурой аллофибробластов. ИГХ с МАТ к виментину, х115.
В первые несколько суток сохраняются микроциркуляторные расстройства, такие как периваскулярный отек, эритростаз, лейкостаз. Одновременно с исчезновением очагов выраженной лейкоцитарной инфильтрации заметно возрастает удельный вес активно фагоцитирующих макрофагов. Лимфо-плазмоцитарная инфильтрация увеличивается преимущественно за счет лимфоцитов Т-супрессоров.Однако уже к 14 сукам количество Т-хелперов возрастает, а на 18 день после проведения остеотрепанации с применением культуры аллофибробластов уже превышает количество Т-супрессоров в ране. Удельный объем фибробластов также интенсивно нарастает. К 14 суткам отмечено разрастание достаточно больших участков молодой грануляционной ткани со значительным количеством пролиферирующих сосудов, чаще всего имеющих вертикальную ориентацию по отношению к поверхности раны.
Новообразованная созревающая молодая соединительная ткань достаточно хорошо васкуляризирована. В участках достаточно зрелой соединительной ткани также отмечено формирование сосудов с пролиферирующими вокруг перицитами, содержащих в цитоплазме промежуточные филаменты актина и виментина. В рядом расположенных фибробластах также выявлены аналогичные промежуточные филаменты, то есть, эти клетки имеют строение, характерное для миофибробластов. При наличии подобной гистологической картины в биоптатах возможно выполнение эффективной аутодермопластики.
Таким образом, в биоптатах из ожоговых ран при комплексном их лечении с проведением остеотрепанации в сочетании с культурой аллофибробластов отмечена благоприятная динамика репаративных процессов с несомненным их доминированием над альтеративно-воспалительными процессами в ожоговой ране.
Выводы.
На основании проведенного морфологического исследования пришли к выводу, что остеотрепанация в сочетании с культурой аллофибробластов значительно ускоряет процесс репарации, наблюдается быстрое увеличение числа фибробластов, функционально активных макрофагов, более раннее формирование грануляционной ткани, что сокращает сроки до возможности проведения эффективной аутодермопластики, и в конечном итоге сокращает время пребывания в стационаре больных с глубокими ожогами голеней.
Литература.
1. Атясов Н.И., Перетягин С.П. Система активного хирургического лечения тяжелообожжённых – новая эра в комбустиологии // Мат. научн. конф. «Актуальные проблемы травматологии и ортопедии». Часть II «Термическая травма». Нижний Новгород.–2001.–С.6-8.
2. Бобро Л.И. Фибробласты и их значение в тканевых реакциях // Архив патологии.–1990.–№12.–С.65-68.
3. Знаменский Г.М., Буркова Н.Я., Эйсмонт Ю.А. и др. Метод целевой малообъёмной гемоперфузии в лечении термических поражений нижних конечностей // Мат. межд. научно–практ. конф. посв. 45-летию Донецкого ожогового центра. «Современные вопросы лечения термических поражений и их последствий». 3-4 июня 2005 г.–Донецк.–С.60-62.
4. Костюкевич В.М., Зозуляк В.Л., Федоришин В.Є. Використання ксенодермотрансплантатів для лікування опіків та обширних дефектів шкіри при скальпованих ранах у дітей // Матеріали ХХI з’їзду хірургів України, Запоріжжя 5-7 жовтня 2005 р.–С.111-112.
5. Лаврухин Ю.Н., Чеглаков Е.В., Арефьев В.В. Методы лечения остаточных ран у обожжённых // Вестник неотл. и восст. мед.–2005.–Том 6, №2.–С.386-387.
6. Мусалатова Х.А. Медицина катастроф (основы оказания медицинской помощи на догоспитальном этапе) – Москва: ГОУ ВУНМЦ МЗ РФ.–2002.–448с.
7. Фисталь Э.Я., Козинец Г.П., Самойленко Г.Е. и др. Комбустиология.–Донецк.–2006.–236с.
8. Фисталь Э.Я., Штутин А.А., Самойленко Г.Е., Солошенко В.В. и др. Органосохраняющие операции при субфасциальных поражениях конечностей // Материалы научной конференции «Актуальные проблемы травматологии и ортопедии». Часть II «Термическая травма». Нижний Новгород.–2001.–С.121-122.
9. Хаджибаев А.М., Фаязов А.Д., Алимов Р.А. и др. Пути оптимизации диагностики и лечения обожжённых // Сборник научных трудов I съезда комбустиологов России. Москва. 17-21 октября 2005 г.–С.33.
10. Хитрихеев В.Е., Рыбдылов Д.Д., Гомбожапов Э.З. Ранняя некрэктомия при циркулярных ожогах голени // Приложение к НМЖ. Комбустиология.–2004.–С.183-184.
11. Шевцов В.И., Попков А.В., Ерофеев С.А. и др. Костеобразование в условиях трансплантации культивированных фетальных фибробластов в диастаз удлиняемой кости // Мат. IIвсероссийского симпозиума «Клинические и фундаментальные аспекты тканевой терапии. Теория и практика клеточных биотехнологий».–Самара.–2004.–С.160-161.
12. Шевченко С.М., Лазаренко В.А., Бурда Ю.Е. и др. Оригинальный способ профилактики лизиса кожного трансплантата у ожоговых больных // Мат. II всероссийского симпозиума «Клинические и фундаментальные аспекты тканевой терапии. Теория и практика клеточных биотехнологий».–Самара.–2004.–С.164-165.
13. Ogle C.K., Kong F., Guo X. at al. The effect of burn injury on suppressors of cytokine signalling // Shock.–2000.–Vol.14, N3.–P.392-398.