ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Ожоговая интоксикация. Дифференцированные подходы к детоксикационной терапии
Козинец Г.П.
Слесаренко С.В.
Шейман Б.С.
Киевский Центр термической травмы и пластической хирургии.
Днепропетровский Центр термической травмы и пластической хирургии.
Отделение токсикологии и экстракорпоральных методов специализированной больницы ОХМАДЕТ.
Ожоговая болезнь — специфический симптомокомплекс, развивающийся после термической травмы и сопровождающийся повреждением всех саморегулирующихся систем. Как правило, ожоговая болезнь развивается, если площадь поверхностного ожога превышает 10-12%, а глубокого 5-6% (рис.1) [1].
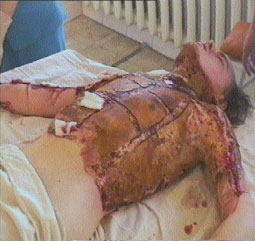
Рис. 1. Ожог пламенем IIIАБ степени 40% поверхности тела верхних конечностей, туловища. Тяжелая ожоговая болезнь.
Разрушающее термическое действие на ткани с раздражением нервной системы вызывает нарушение гемодинамики, микроциркуляции, приводящие к развитию циркуляторно-метаболического синдрома шока и последующим нарушениям функций во всех системах и органах. Из нескольких известных на сегодняшний день теорий ожоговой болезни большинство авторов находят убедительные данные в пользу гистиотоксической концепции патогенеза ожоговой болезни [11,12,13,14]. В ней выделяют последовательные патогенетические звенья: ожоговая рана — токсическая субстанция — высокий протеолиз — снижение неспецифической резистентности — генерализация инфекции [6,7,15] .
Присутствие неспецифических факторов, усугубляющих и дополняющих действие ожоговых токсинов, таких как усиленный протеолиз, активация калликреин-кининовой системы, переокисление липидов мембран клеток и нарушение регуляторного влияния мембран на клеточный метаболизм, выход лизосомальных ферментов в кровь, усиление аутолиза и катаболизма, во многом объясняют полиморфность патогенетических изменений в ранние сроки после ожоговой травмы. Однако интоксикация остается перманентным признаком острого периода ожоговой болезни, а в случаях тяжелого течения интоксикационный синдром становится определяющим для исхода болезни.
В генезе интоксикации представлены три связанных друг с другом звена:
- увеличение количества токсических продуктов, которые присутствуют и в норме, но в значительно меньшем количестве;
- образование новых токсинов — производных прямого термического воздействия на живую ткань, продуктов воспаления и метаболизма микроорганизмов;
- общее подавление механизмов естественной резистентности, способности к детоксикации.
Таким образом, при обширных ожогах имеет место интоксикация различного генеза: гистиогенная и обусловленная бактериальными токсинами, специфическая и сопряженная с многочисленными неспецифическими токсическими метаболитами, биологически активными веществами, продуктами воспаления. При этом саму ожоговую токсемию следует рассматривать как сложную комплексную реакцию, связанную с изменением функции ряда тесно взаимодействующих систем организма. В настоящее время в этой комплексной реакции принято выделять понятия «токсемия» и «эндотоксикоз».
Под термином «токсемия» подразумевается наличие и накопление в кровяном русле токсических агентов в концентрациях, обуславливающих напряжение естественных систем обезвреживания. В то время как «эндотоксикоз» — это каскадный, способный к прогрессированию генерализованый процесс, который обусловлен наличием и накоплением в кровяном русле токсических агентов в концентрациях, вызывающих функциональную несостоятельность естественных систем обезвреживания с последующим повреждением других органов и систем организма в целом. Вполне понятно, что от эффективности и наличия резервных функций антитоксических механизмов, как на уровне органов и тканей, так и всего организма, зависит потенциальная возможность формирования синдрома эндотоксикоза. Если концентрация эндотоксинов не превышает обезвреживающие возможности естественных детоксикационных систем организма, то клиническая манифестация синдрома эндотоксикоза отсутствует. В противном случае происходит развитие токсемии с последующей генерализацией процесса и формированием эндотоксикоза (интоксикационного синдрома), который является клинической манифестацией токсикоза и по степени выраженности отражает различные стадии процесса.
- Первая группа симптомов этого синдрома характеризуется общей слабостью и недомоганием и соответствует напряжению и достаточной функциональной активности адаптогенных и обезвреживающих естественных систем защиты (зона компенсаторных возможностей);
- Вторая группа симптомов характеризуется общей слабостью, недомога-нием на фоне патогномоничных симптомов основного заболевания и соответствует функциональной недостаточности одной из адаптогенных и обезвреживающих систем защиты (реакции субкомпенсации).
- Третья группа симптомов характеризуется общей слабостью, недомоганием на фоне патогномоничных симптомов основного заболевания и симптомов вторичных осложнений и соответствует генерализации процесса токсикоза на фоне функциональной недостаточности двух и более адаптогенных и обезвреживающих систем защиты (реакции декомпенсации).
Наряду с этим, во многих случаях сложно провести дифференциальную диагностику в оценке ряда симптомов и синдромов — относятся ли они к компетенции системы обезвреживания или являются проявлением основного заболевания. В связи с этим необходимо проведение специальных лабораторных исследований, позволяющих подтвердить токсикоз и выявить механизм его формирования.
Современные взгляды на развитие ожоговой интоксикации позволяют выделить следующие пути формирования интоксикационного синдрома (ИС) в организме (табл.1):
|
Таблица 1. |
||
|
N |
Путь формирования ИС |
Механизм развития ИС |
| 1. | Ретенционный | нарушение процессов биотрансформации и\или элиминации из организма; |
| 2. | Обменный | в результате нарушения внутриклеточного гомеостаза и накопления в организме вторичных метаболитов |
| 3. | Резорбтивный | обусловленный массивным образованием и последующей резорбцией в организме продуктов тканевого распада |
| 4. | Инфекционный | обусловленный действием токсических агентов инфекционной природы |
В эволюционном развитии методов лечения этой патологии обосновано возникло и получило развитие целое направление — детоксикационная терапия, которая объединила в себе различные способы выявления и лечения токсикоза [3,4,6,11].
Методы детоксикационной терапии разделяют на 2 группы — консервативные и эфферентные [5,8]. Консервативные методы независимо от механизма обезвреживания, в конечном итоге предусматривают использование резервных возможностей естественных систем элиминации (например: ускоренное выведение токсинов через почки при проведении водной нагрузки с форсированным диурезом). Методы эфферентной терапии обладают способностью удалять токсины собственно из кровяного русла, не вызывая напряжения этих систем. Таким образом, наличие резервных функций у естественных систем элиминации позволяет эффективно использовать консервативные методы детоксикации. Отсутствие же резервных функций указывает на необходимость применения эфферентных методов. Последние, обладая способностью частичного или полного замещения утраченных детоксикационных функций естественных систем обезвреживания, занимают особое место. С их помощью можно осуществить воспроизведение процесса биологической трансформации токсических веществ (микросомальная монооксидазная система печени), связывание ксенобиотиков (иммунная система), воспроизведение функций естественных органов выведения (почки, ЖКТ, легкие) (табл.2).
|
Таблица 2. |
|
|
МЕТОДЫ ДЕТОКСИКАЦИИ |
|
|
Консервативные |
Эфферентные |
| Водная нагрузка (энтеральная или парентеральная) с форсированным диурезом). Сорбционная детоксикация (гастроинтестинальная сорбция,аппликационная сорбция). Диализная терапия (гастроинтестинальный диализ). Токсин связывающая терапия (инфузия токсин связывающих веществ и растворов, гипохлорида натрия, раствора альбумина). Специфическая терапия (применение различных групп антидотов) |
Сорбционные методы (гемосорбция, плазмосорбция, лимфосорбция, ликворосорбция,биосорбция). Диализные методы (гемодиализ, ультрафильтрация).Методы разделительной терапии(обменный плазмаферез, криоплазмоферез,циоферез)Квантовая гемотерапия(ультрафиолетовое \ лазерное облучение крови). |
С помощью методов детоксикационной терапии можно осуществить максимально точное воспроизведение основных физико-химических и структурных принципов естественных механизмов обезвреживания, что в свою очередь является залогом эффективного лечения токсемии, облегчает течение и улучшает прогноз заболевания. Однако, констатация факта наличия токсикоза, даже при использовании значительного набора известных тестов (табл.3), ни в коей мере не может однозначно предопределить выбор к назначению того или иного метода детоксикации, включая методы эфферентной терапии. Т.е., используемые в настоящее время в клинической практике тесты выявляют метаболические и водно-электролитные нарушения, повышение токсичности жидких сред организма, однако не позволяют индивидуализировать детоксикационную терапию, равно как и определить, в каких случаях можно воспользоваться консервативными методами этой терапии, а где необходимо уже применять эфферентные методы детоксикации. Это и поясняет наметившуюся в последнее время тенденцию к сужению показаний для экстракорпоральных методик [17].
|
Таблица 3. |
||
 |
Тесты |
|
|
||
С учетом вышеизложенного, особую важность приобретают сведения о токсикокинетике и токсикодинамике эндогенных токсинов (рис.2), которые наряду с определением интегрального значения степени выраженности
токсикоза и неспецифических характеристик аутоагрессивных веществ, оценкой функционального состояния естественных систем обезвреживания позволят клиницисту наиболее полно и эффективно осуществить комплексное детоксикационное лечение больного. При этом необходимость развития принципиально новых подходов к анализу токсикоза, созданию новой идеологии в лабораторной диагностике этого патологического процесса становится очевидной.
Рис. 2. Распределение, размеры и активность аутоагрессивных веществ в кровяном русле здорового человека (группа доноров)
Примечание:
1. БР — токсины с молекулами больших размеров.
СР — токсины с молекулами средних размеров.
МР — токсины с молекулами малых размеров.
2. Показатели цитолитической активности (ЦА) плазмы у здоровых людей обычно не превышают значение 20% [1]. По нашим данным, вне зависимости от токсин несущей фракции и распределения веществ (потенциальных эндотоксинов) их ЦА не превышает значения 20,3+0,95%.
В этом плане перспективным направлением является изучение различных параметров токсичности токсин несущих фракций крови. Реализация этой идеи привела к разработке комплекса методик, позволяющих фракционировать из крови токсин несущие фракции, разрывать непрочные связи токсинов с этими фракциями и исследовать физико-химические свойства токсинов. Последовательное выполнение таких исследований позволяет определить роль и значение каждой из этих фракций в развитии токсикоза, а клиницисту — правильно определить выбор компонентов для детоксикационной терапии.
Исследование параметров токсикоза
- Цитолитическая активность (токсичность) цельной плазмы.
- Цитолитическая активность альбуминов и ассоциированных с ними токсинов.
- Размеры молекул токсинов ассоциированных с альбуминами;
- Исследование прочности связи токсинов с альбуминами;
- Цитолитическая активность различных токсинов ассоциированных с альбуминами;
- Цитолитическая активность глобулинов и ассоциированных с ними токсинов.
- Размеры молекул токсинов ассоциированных с глобулинами;
- Исследование прочности связи токсинов с глобулинами;
- Цитолитическая активность различных токсинов ассоциированных с глобулинами;
- Цитолитическая активность токсинов не связанных с белками крови.
- Размеры молекул токсинов не связанных с белками крови;
- Цитолитическая активность различных токсинов, не связанных с белками крови;
- Цитолитическая активность токсинов, ассоциированных на мембранах эритроцитов.
- Размеры молекул токсинов ассоциированных с клеточными мембранами;
- Исследование прочности связи токсинов с клеточными мембранами;
- Цитолитическая активность различных токсинов, ассоциированных с клеточными мембранами.
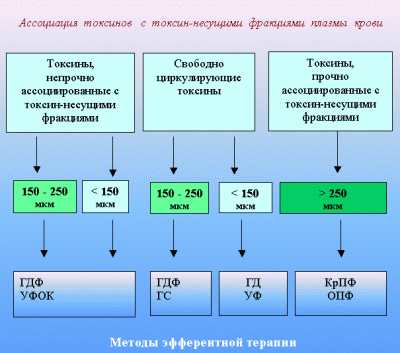
Реализация изложенной программы анализа различных параметров токсикоза позволяет рационально подойти к выбору методов детоксикации вообще и эфферентной терапии в частности. При этом, в зависимости от уровня организации лечебно-диагностической помощи в медицинском учреждении, можно использовать как существующие положения о показаниях (табл. 4.) к проведению различных методов экстракорпоральной детоксикации, так и современные критерии индивидуализации к их использованию (табл. 5. и рис. 3).
Рис. 3. Критерии выбора метода экстракорпоральной детоксикации у больных с ожогами.
Примечание:
1. ГДФ — гемодиафильтрация
2. УФОК — ультрафиолетовое облучение крови
3. ГС — гемосорбция
4. ОПФ — обменный плазмаферез
5. КрПФ — криоплазмаферез
|
Таблица 4. |
|
|
Клинические маркеры |
Лабораторные Маркеры |
| Синдром почечной недостаточности |
|
| и/или | |
| Синдром иммунного воспаления |
|
| и/или | |
| Синдром печеночной недостаточности |
|
| в сочетании с любым из нижеуказанных признаков | |
|
|
|
Таблица. 5. |
|
|
Объект исследования |
Метод экстракорпоральной детоксикации |
| Прочно связанные альбумин ассоциированные токсины большихразмеров. | Обменный плазмаферез. |
| Прочно связанные глобулин ассоциированные токсины большихразмеров. | Криоплазмаферез. Обменный плазмаферез. |
| Непрочно связанные альбумин ассоциированные токсины средних и малых размеров. | Гемодиафильтрация. Гемофильтрация. Гемосорбция. Криоплазмаферез. Обменный плазмаферез. УФОК с форсированным диурезом. Гемодилюция. |
| Непрочно связанные Глобулин ассоциированные токсины средних и малых размеров. | Гемодиафильтрация. Гемофильтрация. Обменный плазмаферез. Гемодиализ. УФОК с форсированным диурезом. Гемодилюция. |
| Свободно циркулирующие токсины больших размеров. | Гемосорбция. Криоплазмаферез. |
| Свободно циркулирующие токсины средних и малых размеров. | Гемосорбция. Обменный плазмаферез. Гемодиализ. Гемодиафильтрация. |
| Прочно связанные с клеточными мембранами токсины большихразмеров. | Обменное переливание крови. |
| Непрочно связанные с мембранами клеток токсины средних и малых размеров. | Отмывание эритроцитов с последующей их реинфузией. |
Примечание:
1. АРОЛ — аутологичное розеткообразование лимфоцитов;
2. ЛПС — липополисахарид;
3. ЦИК — циркулирующие иммунные комплексы;
4. ЛИИ — лейкоцитарный индекс интоксикации;
5. ХПН — хроническая почечная недостаточность;
6. ОПН — острая почечная недостаточность;
7. НГ — нейтрофильные гранулоциты.
Пациенты и методы исследования
Для оценки эффективности программы комбинированной детоксикации у пострадавших с ожогами в остром периоде проведены наблюдения 578 больных, период с 1981 по 1999 годы, среди которых 323 больных составили основную группу, где лечение включало разработанную программу детоксикации и иммунокоррекции; 225 больных, получавших общепринятое комплексное лечение, составили контрольную группу. Вторую контрольную группу составили 55 практически здоровых лиц в возрасте от 18 до 49 лет, у которых исследованы соответствующие лабораторные показатели, использованные для определения эффективности проводимых методов лечения у больных с ожогами. Первая и вторая группы больных были рандомизированы по показателям тяжести травмы, возраста и половой принадлежности.
При определении тяжести состояния больных в качестве интегральной меры использован индекс тяжести поражения (ИТП), представляющий собой модифицированный индекс Франка, и предложенный для выражения тяжести состояния обожженных в остром периоде болезни [9,15].
Наряду с клиническими наблюдениями проведены и лабораторные тесты, где определялись: токсические свойства сыворотки крови и кожи; активность протеаз и их ингибиторов в сыворотке крови, обожженной и необожженной коже; состояние системы крови, включая костномозговое кроветворение, периферическое звено, неспецифические факторы естественной резистентности и адаптационные реакции; состояние иммунологической реактивности; клинико-морфологическая и цитологическая характеристика раневого процесса и исходы лечения пострадавших [6,7,11,16].
Результаты
На основании сопоставления клинических проявлений интоксикации, данных токсикометрии сыворотки крови, а также функциональных возможностей факторов антитоксической резистентности организма пострадавшего от ожогов установлены показания и противопоказания к проведению базовой трансфузионной детоксикации, экстракорпоральной очистки крови от токсических веществ и поврежденных факторов антитоксической резистентности, а также последующей трансфузионной корригирующей терапии.
Показаниями к проведению экстракорпоральной детоксикации крови больного определен уровень токсичности сыворотки крови более 55% при наличии выраженных цитопатологических изменений свыше 60% нейтрофильных гранулоцитов, клинических симптомов эндогенной интоксикации.
Определено, что экстракорпоральные методы способствовали уменьшению токсичности сыворотки крови (рис.4,5) и содержанию среднемолекулярных пептидов высокомолекулярной Ф-1 ( М >10000 ) и низкомолекулярной — Ф-2 ( М < 6000 ) фракций (рис. 6,7) у больных с ожогами различной степени тяжести. Однако продолжительность их детоксикационного действия зависила от исходного уровня интоксикации и находилась в обратной зависимости от тяжести термической травмы.
Токсические свойства экстрактов обожженной кожи у больных свидетельствовали о развитии воспалительной реакции и кореллировали со способами местного лечения. Применение аппликационных сорбентов способствовало уменьшению токсичности экстрактов кожи и снижению поступления токсических веществ из очага поражения в кровоток только в течение 3-4 суток после травмы.
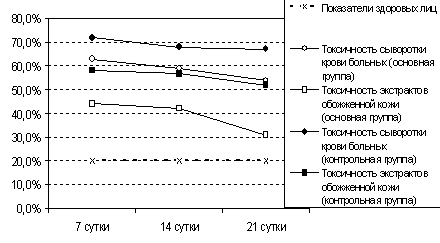
Рис. 4. Токсические свойства сыворотки крови и экстрактов кожи у больных с ожоговой болезнью (%).
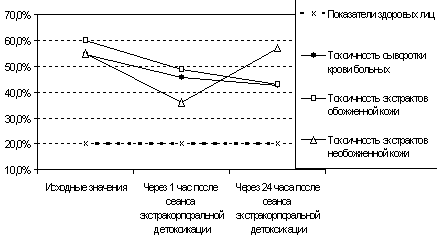
Рис. 5 Токсические свойства сыворотки крови и экстрактов кожи при ожоговой болезни до и после сеансов экстракорпоральной детоксикации.
Снижение токсичности экстрактов обожженной кожи у больных при проведении экстракорпоральных методов детоксикации сопровождалась увеличением функциональной нагрузки на гуморальное звено антитоксической резистентности, вследствие попадания в кровоток низкомолекулярных пептидов из ишемизированных тканей. Однако у больных основной группы в целом система иммунитета работала более адекватно, что выражалось в достаточной продукции иммуноглобулинов в остром периоде и более низком уровне циркулирующих иммунных комплексов.
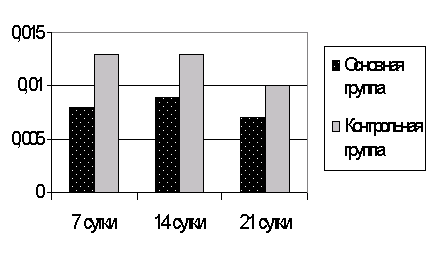
Рис. 6. Концентрация молекул средней массы (Ф-1) в сыворотке крови при ожоговой болезни.
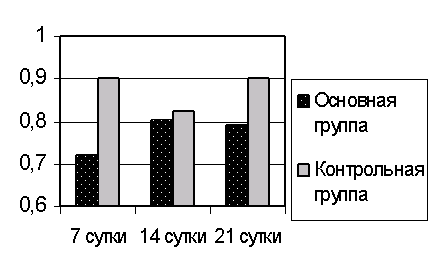
Рис. 7. Концентрация молекул средней массы (Ф-2) в сыворотке крови при ожоговой болезни.
Отмечена существенная роль протеолитических ферментов в патогенезе ожоговой интоксикации. Повышение активности кислых и нейтральных протеаз в сыворотке крови, экстрактах обожженной и необожженной кожи сопровождалось компенсаторным повышением содержания сывороточных ингибиторов a1?ИП и a2?М и значительным увеличением a1?ИП и a2М в поврежденной и неповрежденной коже.
У больных с ожогами определено нарушение баланса между протеолизом и его белковыми ингибиторами, контролирующими эту систему, вследствие чего система протеолиза декомпенсировалась и это являлось важным патогенетическим звеном в развитии деструктивных и воспалительных реакций.
Результаты проведенных исследований свидетельствуют о том, что проводимая сочетанная детоксикационная терапия обеспечивала бoльшую сбалансированность протеазо-антипротеазных систем в сыворотке крови, однако существенную роль играло активное хирургическое очищение ожоговых ран от некротических тканей. Местное лечение с помощью аппликационных сорбентов в свою очередь обеспечивало снижение активности протеаз с накоплением сывороточных ингибиторов в зоне повреждения в течение 3-4 суток после травмы, что предотвращало избыточную деструкцию тканей в паранекротической зоне.
У больных с тяжелыми и, в особенности, крайне тяжелыми ожогами снижалась сбалансированность протеазо-антипротеазных систем в обожженных тканях в период активного очищения ожоговых ран от некротического струпа, что свидетельствовало об интенсивности лейкоцитарной инфильтрации поврежденных тканей со сложным набором протеолитических ферментов, которые участвовали в воспалительных и деструктивных реакциях. Реактивное течение раневого процесса у больных с ожогами крайне тяжелой степени сопровождалось повышением активности кислых протеаз в сыворотке крови.
На основании полученных данных установлено что сочетанные методы детоксикации модулировали развитие раневого процесса за счет изменения активности протеолитических ферментов в зоне ожога в различные фазы развития: при ожогах средней степени тяжести обеспечивали противовоспалительный эффект, а при тяжелых и крайне тяжелых — фазные изменения с обеспечением реактивного течения в период очищения ожоговых ран от некротических тканей.
Результаты исследований кроветворной функции костного мозга у больных с ожогами свидетельствуют о том, что снижение содержания эритроидных элементов сопровождается стимуляцией митотической активности в эритробластической ткани и резким сдвигом эритробластограмм влево (рис.8).
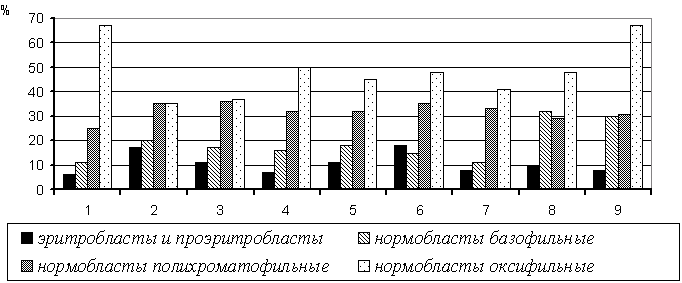
Рис. 8. Парциальная эритробластограмма у больных с обширными ожогами в динамике.
Примечание:
1-значения физиологической нормы;
2-основная группа, 7 сутки после ожога;
3-контрольная группа, 7 сутки после ожога;
4-основная группа, 14 сутки после ожога;
5-контрольная группа, 14 сутки после ожога;
6-основная группа, перед АДП;
7-контрольная группа, перед АДП;
8-основная группа, после АДП;
9-контрольная группа, после АДП.
После проведения комбинированной детоксикации определялось резкое увеличение митотической активности клеток красного ряда, что приводило к более совершенному созреванию эритроцитов. Оптимизация эритропоэза при применении разработанных методов детоксикации позволила авторам уменьшить объёмы заместительной терапии эритроцитсодержащими препаратами в среднем на 20-25%.
Анализ полученных данных в сопоставлении с рутинными исследованиями периферической крови свидетельствует о том, что генез гематологических изменений, находящий отражение в клеточном составе костного мозга при ожоговой болезни оказывается достаточно сложным. Однако факты продукции костным мозгом функционально более полноценных нейтрофильных гранулоцитов (рис. 9,10,11), а также оптимальной количественной продукции базофильных и эозинофильных гранулоцитов и реализации ими воспалительной реакции в зоне ожоговой раны при комбинированной детоксикации можно считать установленными.
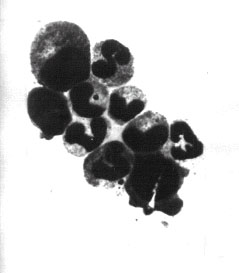
Рис. 9. Биоптаты костного мозга больных с ожогами в остром периоде болезни: а — преобладание сегментоядерных клеточных элементов в пунктате костного мозга у больных контрольной группы; б — близкое к нормальному соотношение ростков кроветворения в пунктате костного мозга у больных основной группы, более совершенная дифференцировка по сравнению с контрольной группой. Окраска по Папенгейму. Ув. 600.
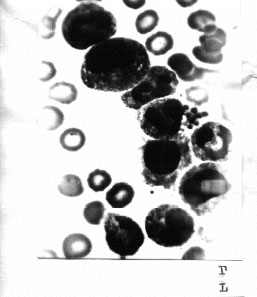
Рис. 9. Биоптаты костного мозга больных с ожогами в остром периоде болезни: а — преобладание сегментоядерных клеточных элементов в пунктате костного мозга у больных контрольной группы; б — близкое к нормальному соо
тношение ростков кроветворения в пунктате костного мозга у больных основной группы, более совершенная дифференцировка по сравнению с контрольной группой. Окраска по Папенгейму. Ув. 600.
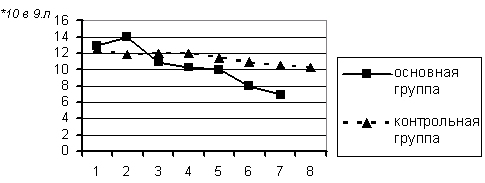
Рис. 10. Динамика содержания в периферической крови общего количества лейкоцитов у больных с ожогами.
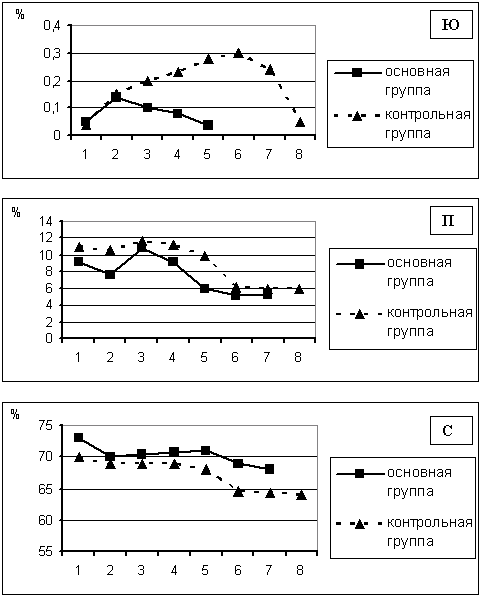
Рис. 11. Динамика процентного соотношения юных — [Ю], палочкоядерных — [П] и сегментоядерных форм нейтрпофильных гранулоцитов — [С] в периферической крови у больных с ожогами.
Примечание:
1 — 3 сутки; 2 — 7 сутки;
3 — 14 сутки; 4 — 22 сутки;
5 — 29 сутки; 6 — 56 сутки;
7- 63 сутки; 8 — 72 сутки после травмы.
Определено, что при ожоговой болезни формируются компенсаторно-приспособительные реакции, наиболее неблагоприятной среди которых является реакция стресса (рис.12). Доказана эффективность комбинированной детоксикации, ее позитивное влияние на развитие адаптационно-приспособительных реакций в организме пострадавших от ожогов при низком индексе адаптации. При низких значениях соотношения лимфоцитарных и гранулоцитарных клеточных элементов в периферической крови, менее 0,17, проведение экстракорпоральной детоксикации было эффективным в повышении адаптационно-приспособительных резервов организма (рис.13). У больных с исходно высоким индексом адаптации, более 0,20, проведение экстракорпоральных методов лечения приводило к срыву адаптации и снижению адаптационно-приспособительных резервов. Проведение терапии с использованием предложенного способа определения показаний к проведению экстракорпоральной детоксикации позволило существенно снизить количество реакций и осложнений».
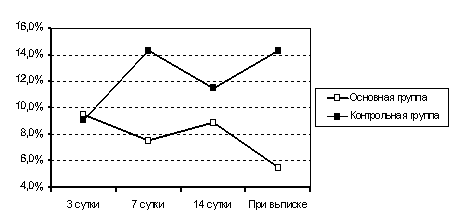
Рис.12 Развитие адаптационной реакции стресса у больных с ожоговой болезгью (%).
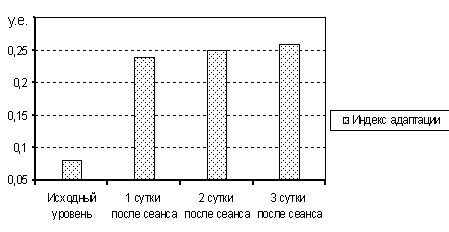
Рис.13 Изменение индекса адаптации у больных с ожоговой болезнью при проведении экстракорпоральной детоксикации (у.ед.).
Показана эффективность проводимых методов детоксикации в повышении неспецифической резистентности организма пострадавших от ожогов. Так, авторами установлено, что повышенная способность к захвату чужеродного материала сопровождалась развитием внутриклеточной патологии и формированием микроагрегатов при гиперактивности мембран нейтрофильных гранулоцитов. Снижение активности внутриклеточных бактерицидных систем нейтрофильных гранулоцитов периферической крови пероксидазы и неферментных катионных белков на фоне низкого содержания в цитоплазме клеток специфических гранул способствовало развитию в ранние сроки после травмы незавершенного фагоцитоза.
В ранний послешоковый период определено значительное снижение фагоцитарных показателей нейтрофильных гранулоцитов в капиллярной крови из пораженной и непораженной кожи пропорционально тяжести термической травмы.
При миграции в зону термического повреждения нейтрофильные гранулоциты в значительной степени утрачивали активность пероксидазы при повышении содержания неферментных катионных белков, проявляющих своё бактерицидное действие в кислой среде раневого отделяемого. Факт накопления катионных белков в нейтрофильных гранулоцитах раневого отделяемого можно объяснить, по всей видимости, реутилизацией катионных белков, высвободившихся в очаге воспаления при распаде лейкоцитов с формированием резорбтивной резистентности.
Установлено, что снижение в нейтрофильных гранулоцитах среднего цитохимического коэффициента миелопероксидазы и катионных белков ниже 0,8 являлось прогностическим признаком развития ранних инфекционных осложнений у больных с ожогами.
При применении аппликационных сорбентов определено, что фагоцитарные показатели нейтрофильных гранулоцитов капиллярной крови зоны термической травмы и неповрежденной кожи в ранние сроки после травмы больных всех групп отличались незначительно, что свидетельствовало о снижении токсического воздействия на фагоцитирующие клетки поврежденных тканей.
Применение эфферентной детоксикации способствовало притоку в капилляры зоны термической травмы функционально более активных нейтрофильных гранулоцитов с высокой мембранной активностью (рис.14). Причем, если у больных с ожогами средней и тяжелой степеней накопление функционально более активных нейтрофильных гранулоцитов происходило в основном за счет перераспределительных реакций между периферической и капиллярной кровью зоны поражения, то у больных с крайне тяжелыми ожогами перераспределительные реакции были замедлены, и это сопровождалось накоплением функционально активных нейтрофильных гранулоцитов в периферической крови. Наиболее выраженная такая реакция наблюдалась через 1 сутки после проведения эфферентной детоксикации.
Проведение экстракорпоральной детоксикации способствовало увеличению молодых форм нейтрофильных гранулоцитов в периферической крови, наряду с уменьшением количества разрушающихся клеток, в особенности у больных с крайне тяжелыми ожогами. В большинстве гранулоцитов отмечалось довольно высокое содержание гранул разных типов, со значительным уменьшением признаков незавершенности фагоцитоза. Весьма характерным для нейтрофильных гранулоцитов периферической крови в первые сутки после экстракорпоральной детоксикации было высокое содержание гранул гликогена, иногда формировавших довольно крупные скопления (рис. 15).
Рис. 14. 7-е сутки после ожога. Группа нейтрофильных гранулоцитов периферической крови с выростами цитоплазмы. В цитоплазме клеток нейтрофильные гранулы и фагосомы. Ув 6000.
Рис. 15. 14-е сутки после ожога. Участок нейтрофильного гранулоцита периферической крови. Диффузное рассеивание гранул гликогена по цитоплазме клетки, небольшие фагосомы. Ув. 20000.
Сравнительный анализ ультраструктурной организации нейтрофильных гранулоцитов и определение их функциональной активности по НСТ тесту (рис.16) позволило сделать заключение о том, что разработанный комплекс терапии у больных основной группы приводил к большей сбалансированности процессов поглощения и переваривания микроорганизмов в нейтрофильных гранулоцитах. У больных с крайне тяжелыми ожогами эффект экстракорпоральной детоксикации в повышении функциональных возможностей гранулоцитов в большинстве наблюдений был кратковременным, что требовало многократности ее проведения.
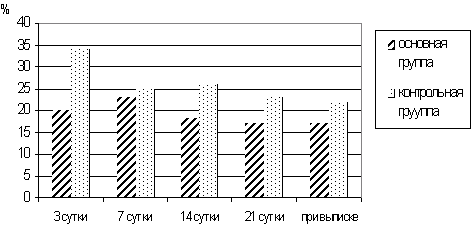
Рис.16. НСТ — тест НГ периферической крови у больных с ожогами в динамике.
Показано, что повышение противоинфекционной резистентности больных после проведения экстракорпоральной детоксикации способствало также увеличению активности внутриклеточных бактерицидных систем и PAS-положительных веществ нейтрофильных гранулоцитов как в периферической крови, так и в зоне термической травмы. Более быстрое очищение ран от девитализированных тканей у этой категории больных в свою очередь способствовало повышению фагоцитарной активности нейтрофильных гранулоцитов.
Результаты проведенных исследований свидетельствуют, что применение разработанной комплексной терапии в сочетании с активным хирургическим лечением ожоговых ран обеспечивало повышение неспецифической резистентности организма больных с различной тяжестью термической травмы в период подготовки к оперативному восстановлению кожного покрова.
Показано, что для костного мозга у больных с ожогами, которым проводилась экстракорпоральная детоксикация, характерно снижение продукции лимфоцитов в остром периоде ожоговой болезни. В эти же сроки поддерживается лимфопения и в периферической крови. После пластического закрытия ран число этих клеток возрастает в костном мозге и периферической крови. Эта тенденция сохраняется и в отношении количественного состава Е-РОК и ЕАС-РОК, а содержание «нулевых» клеток имеет обратную динамику. Полученные данные свидетельствовали о корреляционной зависимости между количеством «нулевых» лимфоцитов и активностью репаративной регенерации. После заживления обширных ожоговых ран количество «нулевых» клеток резко снижалось, в отличие от больных, которым экстракорпоральные методы детоксикации не проводились. Эффективность комбинированной детоксикации у больных с ожогами подтверждена сбалансированным взаимодействием субпопуляций Т-хелперов и Т-супрессоров по мере уменьшения площади ожога при его заживлении, выражающихся в возрастании относительного содержания супрессорных элементов, снижении эффекторной работы всей иммунной системы.
Более высокая концентрация иммуноглобулина G в остром периоде у больных, которым проводилась комбинированная детоксикация, обеспечивала эффективную защиту от инфекционных осложнений (рис. 17)
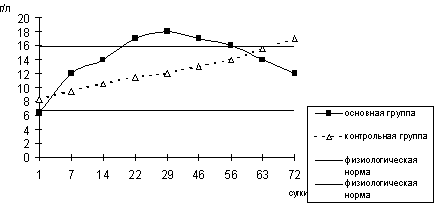
Рис. 17. Динамика содержания иммуноглобулина G в периферической крови больных с тяжелыми ожогами.
Напряженность гуморального иммунитета к различным антигенам у больных при проведении комбинированных методов детоксикации отражало адекватную потребностям эффекторную работу В-системы иммунитета в период очищения ран от некротических тканей, с последующим снижением функциональной активности и предотвращением риска аутоиммунных осложнений при восстановлении утраченного кожного покрова.
На основании клинико-морфологических исследований установлено выраженное влияние комплексных методов детоксикации на течение раневого процесса у больных с различной тяжестью термической травмы.
При применении у больных с ожогами комплексной программы детоксикации отмечено укорочение экссудативной фазы воспалительной реакции, более раннее развитие демаркации без выраженного гнойного отделяемого, более легкое отторжение струпа с обнажением ровной поверхности развивающейся грануляционной ткани и сохранение в значительном количестве жизнеспособных эпителиальных элементов кожи.
Отличительной особенностью развития раневого процесса на 5-е сутки после травмы у больных, которым проводилась комбинированная детоксикация, было чёткое отграничение демаркационным валом зоны первичного некроза от подлежащих отделов сетчатого слоя. Демаркационный вал у этих больных состоял из большего числа клеточных элементов с высокой плотностью их расположения, с преобладанием крупных макрофагов и более высокой их функциональной активностью (рис.18,19)

Рис. 18. Четкое отграничение демаркационным валом зоны первичного некроза от ниже лежащих отделов дермы в биоптатах больных основной группы. 7 сутки после термического ожога. Парацентральная зона ожоговой раны. Окраска гематоксилин эозином. Ув. 300.

Рис. 19. Признаки формирования второго демаркационного вала в глубоких отделах сетчатого слоя дермы в биоптатах больных контрольной группы. Парацентральная зона ожоговой раны. 7сутки после термического ожога. Окраска гематоксилин эозином. Ув. 63.
Определено, что морфологические изменения, выявляемые в биоптатах больных на 14-21 сутки после травмы, отражали динамику стадии пролиферации процесса репаративной регенерации, причем выраженность пролиферативных процессов коррелировала с тяжестью ожога и была различной в биоптатах парацентральной и краевой зон ожоговой раны.
Отличительными признаками в этот момент были большее количество сосудов в грануляционной ткани, а также значительно меньшая их проницаемость. В составе грануляционной ткани у больных после комбинированной детоксикации определялось большее количество клеточных элементов с более высокой функциональной активностью — фибробластов и клеток лимфогистиоцитарного ряда. В глубоких слоях грануляционной ткани волокнистые структуры определялись более зрелыми.
В биоптатах больных с глубокими ожогами, которым проводилась комбинированная детоксикация определялись признаки формирования грануляционной ткани в предлежащей основе. Эта ткань характеризовалась большим количеством функционально активных нейтрофильных гранулоцитов и макрофагов, в то время как у больных контрольной группы на фоне диффузно инфильтрированной микрофлорой раневой поверхности определялась дистрофия волокнистых структур и наличие очагов с некрозом прилегающих тканей.
В целом, у больных основной группы отмечено уменьшение воспалительных изменений с формированием более совершенного фагоцитарного типа воспалительной реакции в ранние сроки после травмы, с активацией и развитием более совершенных пролиферативных процессов на 2-3 неделе после ожоговой травмы.
Результаты морфологических и цитологических исследований свидетельствуют о том, что проводимая в ранние сроки после ожога комбинированная детоксикация обеспечивает значительное сокращение катаболической фазы регенерации, показателем которой является динамика распавшихся и дегенеративно измененных клеточных элементов. Оптимизация регенеративного процесса в значительной степени сводилась к достаточно быстрой нормализации функциональных расстройств в сосудистом русле окружающих рану тканей, что препятствовало развитию деструктивных изменений в его терминальных отделах. У больных уже на ранних этапах формирования грануляционной ткани получали широкое развитие процессы пролиферации и дифференцировки как эпителиальных элементов, так и ретикулярной стромы кожи. Уже на ранних этапах формирования грануляционной ткани получали широкое развитие биоэнергетические процессы: активный и эффективный фагоцитоз, пролиферация и дифференцировка эпителия, капилляров и клеточных элементов ретикулярной и паренхиматозной тканей.
Разработанная комплексная терапия обожженных способствовала предупреждению углубления ожоговых ран, активации репаративных процессов и уменьшению площади глубоких ожоговых ран у больных с ожогами средней, тяжелой и крайне тяжелой степени.
Так, у больных основной группы с ожогами средней степени тяжести при площади ожоговых ран 22,3% поверхности тела, площадь глубоких ожоговых ран составляла 2,2% поверхности тела. Полная эпителизация ожоговых ран отмечена у 70% пострадавших данной группы. В 30% случаев было произведено оперативное восстановление утраченного кожного покрова. Произведено в среднем 2,36 операций аутодермопластики расщепленными кожными лоскутами на поверхности 1001,8 см2 гранулирующих ран у каждого пострадавшего. Первая аутодермопластика у них выполнена на 23 сутки. Из числа пострадавших данной группы выздоровели все пострадавшие, средний койко-день составил 29. У больных контрольной группы с ожогами средней степени тяжести при площади ожоговых ран 20%, площадь глубоких ожоговых ран составила 6,6%, что в 3,6 раза (Р<0,001) превышало аналогичный показатель у больных основной группы. Первая аутодермопластика у больных контрольной группы выполнена на 25 день. Общая летальность составила 3,2%, средней койко-день выздоровевших больных — 58, что в два раза (Р<0,001) превышало показатели у больных основной группы.
В основной группе больных с тяжелыми ожогами при средней площади ожоговых ран 31,1% площадь глубоких поражений IIIБ степени составила 4,6% поверхности тела. Полная эпителизация ожоговых ран отмечена у 35% пострадавших данной группы. В 65% случаев проведено оперативное восстановление утраченного кожного покрова. Первая аутодермопластика у них была выполнена на 25й день после травмы, произведено в среднем 2,45 операций аутодермопластики на одного больного, расщепленными кожными трансплантатами и закрыто в среднем 1010 см2 гранулирующих ран. Из числа пострадавших данной группы умерло 12,1% при осложненных формах ожоговой болезни. Средний койко-день среди выздоровевших пациентов составил 54. У больных контрольной группы при площади ожоговых ран 31,3%, площадь глубоких поражений IIIБ степени составила 12,5%, что в 2,7 раза (Р<0,001) превышало аналогичный показатель у больных основной группы. Первая аутодермопластика у больных контрольной группы выполнена на 28й день. Общая летальность составила 25%, что в 2,1 раза выше, чем у больных основной группы. Средний койко-день выздоровевших больных контрольной группы составил 64. Т.е., длительность стационарного лечения больных контрольной группы была больше на 19% по сравнению с основной группой.
В основной группе больных с крайне тяжелыми ожогами при площади ожоговых ран 50,1% средняя площадь глубоких поражений IIIБ степени среди выздоровевших больных составила 14% поверхности тела. Полная эпителизация обширных ожогов по островковому типу отмечена у 14% пострадавших данной группы. В 86% случаев было проведено оперативное восстановление утраченного кожного покрова. Первая аутодермопластика у них выполнена на 25й день после травмы, проведено в среднем 5,13 операций аутодермопластики расщепленными кожными лоскутками на одного больного и закрыто в среднем 2590 см2 гранулирующих ран. У большинства больных с тяжелыми и крайне тяжелыми ожогами были применены сетчатые аутотрансплантаты с коэффициентом увеличения 1:3. У 5и больных с тяжелыми и у 12и с крайне тяжелыми ожогами с целью временного закрытия ран были использованы ксенодермотрансплантаты. Из числа пострадавших данной группы умерло 44,7% при осложненных формах ожоговой болезни. Средний койко-день среди выздоровевших больных составил 64,5. У больных контрольной группы при площади ожоговых ран 51,1% площадь глубоких поражений IIIБ степени среди выздоровевших больных составила 19,9%, что в 1,44 раза (Р>0,05) превышало аналогичный показатель у больных основной группы. Первая аутодермопластика у больных контрольной группы выполнена на 25 сутки после травмы. Общая летальность составила 60%, что на 34,2% больше, чем в основной группе больных. Средний койко-день выздоровевших больных контрольной группы составил 81, что на 25,4% (Р>0,05) превышало показатели у больных основной группы.
В среднем, у больных основной группы при общей площади термического поражения (TBSA)1 34,7%, площадь глубоких ожогов (DBSA)2, требующих пластического замещения дефекта кожи, составила 6,9%. У больных контрольной группы при общей площади поражения 34%, площадь глубоких ожогов составила 13% (рис. 20). Сравнение групп по данным показателям свидетельствует о том, что раннее применение комбинированной детоксикации у обожженных способствует адекватному дренированию зон парабиоза и активации регенераторных процессов в них, что выражается в достоверном уменьшении площади глубоких поражений и соответственно способствует сокращению этапов и сроков хирургического лечения пострадавших.
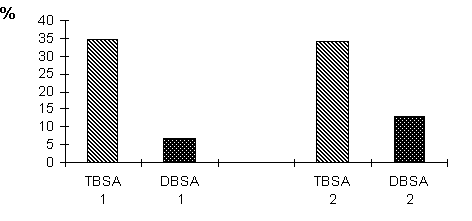
Рис. 20. Влияние комбинированных методов детоксикации в остром периоде на величину площади глубоких термических ожогов (DBSA).
Примечание:
1- основная группа;
2- контрольная группа.
Представленные материалы свидетельствуют о существенном улучшении лечения больных с ожогами различной степени тяжести при раннем применении комбинированных методов детоксикации, заключающиеся в уменьшении площади глубоких поражений, снижении летальности и укорочении сроков выздоровления пострадавших.
Заключение
В работе доказано, что разработанная авторами комплексная программа диагностики и терапии интоксикации для больных с ожогами различной степени тяжести способствовала предупреждению углубления ожоговых ран, активации репаративных процессов, уменьшению площади глубоких поражений, снижению летальности больных с критическими ожогами и укорочению сроков выздоровления пострадавших.
Литература
- Большая медицинская энциклопедия. В 30-ти т., Т.17 / Гл. ред. Б.В.Петровский.- 3-е изд.- М.: Сов. Энциклопедия, 1987.- 512 с.
- Боярская А.М., Жуков Г.М. Лейкоцитарные воспалительные реакции в ожоговой ране у детей при ранней некрэктомии с одномоментной аутодермопластикой / Матер_али ХIX з’їзду х_рург_в України.- Харк_в, 2000.- С. 307-308.
- Власов С.В., Власова И.В., Кравченко А.И., Крейнес В.М. Эффективность метода экстракорпоральной криоплазмасорбции в восстановлении эндотелийзависимой вазодилатации // Эфферентная терапия. -1998. -Т.4, N3. -С.31-35.
- Гендель Л.Л., Белоцерковский М.В., Гуревич К.Я. Использование полуселективного метода экстракорпоральной гемокоррекции для лечения больных распространен-ными формами атеросклероза, требующих интенсивной терапии // Анест. и реаниматол. — 1994. -N 2. -С.53-55.
- Дев’ятк_н О.Б., _саков В.М., Бесараба М.Д., Соколов Г.Е., Палагнюк Б.Л. Викорис- тання метоклопрам_ду при гострому отруєнн_ клофел_ном // Б_ль, знеболювання та _нтенсивна терап_я. -2000. -N 1(д). -С.120-122.
- Г.П.Козинец, Б.С.Шейман, С.В.Слесаренко, О.И.Осадчая. Эндотоксикоз при ожогах и электротравмах и дифференцированные подходы к его лечению // Матер_али ХХ з’їзду х_рург_в України. Т.2., Терноп_ль: «Укрмедкнига» .- 2002.- С.617-619.
- Козинец Г.П. Патогенетическое обоснование различных методов дезинтоксикациипри ожоговой болезни и влияние их на течение раневого процесса: Автореф. дис. … д-ра мед. наук.- К., 1992.- 37 с.
- Локай Б.А. Обгрунтування застосування пен_цил_ну в терап_ї отруєнь бл_дою поганкою // Б_ль, знеболювання та _нтенсивна терап_я. -2000. — N 1(д). -С.125-126
- Муразян Р.И.,Панченков Н.Р.Экстренная помощь при ожогах.- М.: Медицина,1983.- 180 с.
- Острая ожоговая токсемия, как центральная проблема современной комбустиологии/ В.Т.Зайцев, Д.Е.Пекарский, П.В.Волошин и др.// 2-я Всесоюзная конф. по проблеме «Глу- бокие и обширные ожоги».- М., 1979.- С. 17-18.
- Ожоговая интоксикация. Патогенез, клиника, принципы лечения. / Г.П. Козинец, С.В.Слесаренко, Радзиховский А.П., Повстяной Н.Е., Шейман Б.С.- Киев, 2003.- 209 с.
- Пекарский Д.Е. Концепция патогенеза и принципы терапии острой ожоговой токсемии // Клинич. хирургия.- 1978.-N3.- С. 30-33.
- Пекарский Д.Е., Захарченко О.М. Острая ожоговая токсемия / / Клинич. хирургия.- 1980.- N 3.- С. 55-59.
- Повстяной Н.Е., Козинец Г.П. Патогенез и основы направленной терапии острого периода ожоговой болезни и детей //Клинич. хирургия.- 1989.- N 3.- С. 22-25.
- Патогенез и лечение пострадавших в остром периоде ожоговой болезни: метод. рекомендации/ Сост.: Н.Е.Повстяной, Г.П.Козинец, Т.В. Сосюра и др. — К., 1989.- 23 с.
- Слєсаренко С.В. Розробка та визначення ефективност_ комб_нованих метод_в детоксикац_ї для п_двищення натуральної резистентност_ орган_зму при оп_ков_й хвороб_. Автореф. дис….д-ра мед. наук. Дн_пропетровськ, 1996.- 34 с.
- Белобородов В.Б. Современные представления о применении методов экстракорпоральной детоксикации у пациентов с бактериальными инфекциями/ http:// http://www.rmj.ru/main.htm / kah/ t2/ n1/ 28.htm
Designed by Сайт на Заказ