ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Патогенез, классификация, диагностика и лечение отёчного синдрома у обожжённых
Фисталь Э.Я.
Сперанский И.И.
Самойленко Г.Е.
Арефьев В.В.
Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины, отдел термической травмы и пластической хирургии ( зав. профессор Э.Я. Фисталь),
г. Донецк, Украина
Под отёчным синдромом у обожжённых следует подразумевать увеличение объёма конечности или другого участка тела вследствие патологических изменений на любом уровне в ответ на термическую травму или её осложнение.
Borres M., 1995
Отёчный синдром у обожжённых являясь одним из патогенетических звеньев течения раневого процесса в ожоговой ране или развития различных осложнений и /или неадекватной терапии ожоговой раны и ожоговой болезни развивается у 17 – 68% обожжённых и является одной из причин неудовлетворительных результатов лечения, а порой — инвалидизации и летальности пострадавших. Отёк тканей, развивающийся в зоне повреждения, приводит к дальнейшим ишемическим и гипоксическим нарушениям и в конечном счёте к некрозу – апоптозу клеточных структур. Поэтому предупреждение и купирование отёчного синдрома при критических состояниях является важной задачей и должно включаться в комплекс интенсивной терапии [17].
Под отёчным синдромом у обожжённых следует подразумевать увеличение объема конечностей, участка тела или органа вследствие патологических изменений в ответ на термическую травму, её осложнение или оперативное вмешательство во время лечения ожога или его последствий. Основной причиной отёка является задержка воды в организме в результате нарушения обмена воды между кровью и тканями.
Знание механизмов развития отёков является важным при разработке эффективной профилактики и терапии данной группы больных. В патогенезе развития отёка важная роль принадлежит нарушениям газообмена, системной и регионарной гемо – и лимфодинамики, повышению проницаемости сосудистых и клеточных мембран, нарушениям физиологического равновесия между водными секторами, метаболическим и воспалительным изменениям [17]. После термической травмы отёчный синдром после развивается в основном в результате повышения проницаемости сосудистой стенки и перехода внутрисосудистой жидкости в интерстициальное пространство неповреждённых тканей. В обожжённых тканях повышается осмотическое давление, что служит усилению тока жидкости в эту зону и усугублению отёка обусловленного увеличением количества ионов натрия. Осмолярность интерстициальной жидкости повышается ещё больше за счёт последующего выхода в неё из сосудистого русла белка, в основном альбуминов, обладающих способностью удерживать воду массой, в 17 раз превышающую массу самого белка. Высокое содержание белков в интерстициальной жидкости приводит к повышению онкотического давления и ретенции жидкости в межклеточном пространстве. В результате ликвидация высокобелкового отёка требует значительных лечебных усилий в отличие от других отёков, которые регрессируют по достижении компенсации основного заболевания [6,7]. От потери белка, циркулирующего в сосудистом русле, во многом зависит развитие отёка в необожжённых тканях, который особенно выражен при ожогах свыше 30% поверхности тела. При тяжелых ожогах, вследствие нарушения проницаемости клеточных мембран, ионы натрия из внеклеточного пространства проникают в клетку и влекут за собой воду, что грозит развитием внутриклеточного отёка. В последствии в поражённых участках развивается воспалительный процесс, который усиливает отёк поражённых тканей и зоны паранекроза. Явления отёка мягких тканей, нарушение венозной и артериальной микроциркуляции, увеличение проницаемости сосудистой стенки, которые развиваются в ответ на термическую травму сопровождаются болью, ограничением функции конечности и участка тела, а порой и отдельного органа. Такой патологический процесс выделяется в литературе как ранний отёчный, отёчно – болевой или отёчно- воспалительный синдром.
Нередко у обожжённых в первые 4-7 дней после ожога, особенно при поражении более 30% поверхности тела, из-за выхода альбумина из сосудистого русла в межклеточное пространство, неадекватной терапии с использованием преимущественно солевых растворов развивается гипоальбуминемия, которая также способствует развитию генерализованных и локальных отёков. При передозировке изотонического раствора здоровые почки через некоторое время выделяют его. При нарушении функции почек, что наблюдается у обожжённых в период ожогового шока и токсемии, введение большого количества жидкости вызывает гиперволемию, развивается застойное легочное сердце, повышается центральное венозное давление и в конечном итоге развивается отёк легких [14]. В период шока и токсемии у больных нередко снижен аппетит, выражен парез кишечника, что часто приводит к неукротимой рвоте, а в результате развивается синдром неполноценного и недостаточного питания и гипопротенемия, которые также проявляются отёчным синдромом. При отёке состав внутрисосудистой и интерстициальной жидкости изменяется. Гипопротенемия приводит к снижению коллоидоосмотического давления в плазме и повышению в интерстиции. К этому присоединяются явления вторичной гиперальдостеронической задержки натрия, ухудшения лимфообращения, что затрудняет транспорт из интерстициальной ткани, что клинически проявляется отёчным синдромом [14].
Известно, что на ожог как и на любую травму, включая операционную, организм отвечает неспецифической воспалительной реакцией, которая является адаптационно – компенсаторно — защитной реакцией организма и проявляется не только болью и выбросом цитокинов и лизосомальных ферментов, но и отёком. Выраженность этой реакции зависит от площади и глубины поражения, величины, характеристики инфекционного агента и иммунного состояния пострадавшего. [20]
В процессе развития любой воспалительной неспецифической реакции организма на травму происходит выброс медиаторов воспаления (гистамин, серотонин, катехоламины, цитокины и др.), которые сначала вызывают кратковременный спазм сосудов в очаге поражения, а затем стойкую вазодилятацию, гиперемию кожных покровов, местную и общую гипертермию, ацидоз. В очаге воспаления и в зоне паранекроза, в результате повышенной проницаемости из сосудов мигрирует плазма и форменные элементы крови, уменьшается скорость кровотока, происходит агрегация тромбоцитов и тромбообразование, выпадают в осадок сгустки фибрина и кровяные сгустки. Продукты распада поврежденных тканей стимулируют образование лейкоцитарного вала вокруг неспецифического воспаления. Повышенная проницаемость стенок сосудов и клеточных мембран приводят к развитию отёка тканей в области ожога [11,21].
Венозный стаз, который развивается в период ожогового шока и в начале токсемии, снижает доставку кислорода к тканям, создавая их ишемию. Тяжелая и продолжительная гипоксия тканей активирует эндотелиальные клетки, которые освобождают медиаторы воспаления и митогенные молекулы. Медиаторы воспаления индуцируют адгезию нейтрофильных лейкоцитов и непрямым путём индуцируют пролиферацию гладкомышечных клеток. Во время процесса адгезии лейкоциты активируются и освобождают свободные радикалы и протеазы. Они могут повреждать многочисленные биологические молекулы (например, коллаген). Пролиферирующие гладкомышечные клетки изменяют свой фенотип и утрачивают способность к физиологическому сокращению, как в нормальной венозной стенке.
Венозный стаз приводит к церебральной ишемии и цитотоксическому отёку, возникающему вследствие развившегося метаболического ацидоза. Различают две стадии формирования цитотоксического отёка. Вначале ишемическая гипоксия ведёт к деполяризации клеточных мембран, нарушению функционирования натрий – калиевого насоса и вхождения в клетки мозга внеклеточной жидкости. Вторая стадия отёка возникает в силу повреждения гематоэнцефалического барьера, чему способствуют нарушение адренэргической несимпатической иннервации мозговых сосудов. В мозг поступают белки и вода из системного кровеносного русла, развивается вазогенный внеклеточный отек [10].
Важная роль в развитии отёка принадлежит повреждению сосудистого эндотелия – высокоактивного метаболического органа, играющего важную роль в поддержании гомеостаза. В результате повреждения эндотелиоцитов утрачивается регулярный контроль организма над рядом его функций (барьерной функции, тонуса сосудов, системы гомеостаза, местного воспаления), в результате чего развивается микрососудистая дисфункцмя, ишемия, отёк [1, 17].
Кроме перечисленных причин, основанием для развития отёчного синдрома в области поражения у обожженных могут быть как механические (сдавление периферического участка конечности циркулярным ожоговым струпом с последующим развитием компартмент — синдрома, неудобное положение в постели, тугая повязка и т.д.), так и воспалительные процессы и другие осложнения в ранах и околораневой зоны (нагноение ожоговых ран, флебиты, тромбофлебиты и т.д.), нарушение гемодинамики и реологических свойств крови, нарушение обмена веществ, сопутствующие заболевания внутренних органов и др.
Факторами риска развития отёчного синдрома у обожжённых являются:
1. Наличие циркулярных глубоких ожогов на конечностях и туловище;
2. Ожоги особой локализации (лицо, кисть, наружные половые органы);
3. Глубокие, порой ограниченные, электроожоги конечностей;
4. Неадекватное местное лечение ожоговых ран и/или присоединившееся гнойно-воспалительное осложнение;
5. Неадекватная инфузионная терапия по составу и объёму жидкостей (чаще всего чрезмерные объёмы или большая скорость введения);
6. Сопутствующие заболевания (сахарный диабет, пиэлонефрит, нефротический синдром, сердечно-сосудистая недостаточность, отёки беременных, ортостатические оттёки, острый тромбоз глубоких вен или хроническая венозная недостаточность, лимфедема).
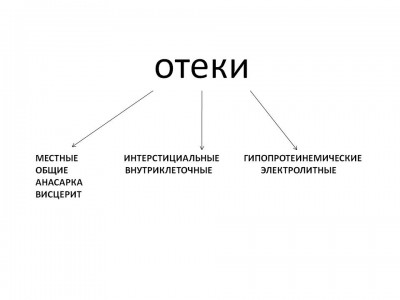
Существующие классификации отёков [8,9] делят их на местные и общие, интерстициальные, внутриклеточные, гипопротенемические и электролитные (рис.1).
Рис. 1. Классификация отеков (Д.Д. Иванов, С.В. Кушниренко, 2006).
В зависимости от причин возникновения отёка различают отёки: сердечные, почечные, кахектические, воспалительные. Токсические, нейрогенные, аллергические, лимфогенные и др. [12].
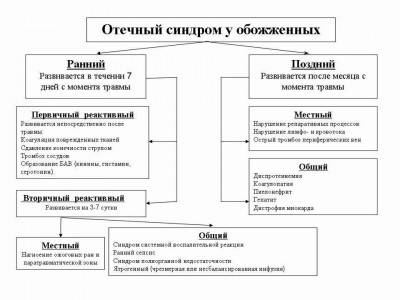
У пострадавших с термической травмой (рис.2), мы различаем ранний отёчный синдром обожжённых, который развивается непосредственно после ожога в первые 7 дней с момента травмы. Он делится на первичный реактивный – первые — двое суток, и вторичный реактивный, развивающийся на 3-7 сутки. Причиной раннего реактивного отёка у обожжённых является коагуляция поврежденных тканей с тромбозом сосудов, сдавлением конечности циркулярным плотным ожоговым струпом, образование биологически активных веществ (БАВ): кинины, гистамин, серотонин и др. Вторичный реактивный отёчный синдром у обожжённых развивается на 3-7 сутки и подразделяется на местный в результате воспалительные изменений в ране и паратравматической зоне. Общий реактивный отёчный синдром у обожжённых, развивающийся на 3-7 сутки с момента травмы, является проявлением синдрома воспалительной реакции (воспалительного ответа), раннего сепсиса, синдрома полиорганной недостаточности. Нередко причиной общего отека является передозировка инфузионной терапии или не рациональный её состав.
Рис. 2. Классификация отечного синдрома у обожженных
Так, что такое отёк (отёчный синдром) у обожжённых? Вопрос не риторический, как может показаться на первый взгляд. Часто понятие врача об этом состоянии и представления пациента, жалующегося на отёк, расходятся весьма значительно [6,7]. Порой пациенты и даже врачи, за отёк принимают тяжесть в конечностях при некоторых венозных заболеваниях или после длительной инфузии через катетер или флексулю, увеличение объёма жировой клетчатки после приёма гормональных препаратов и т.д., хотя признаков отёчного синдрома во время визуального осмотра и пальпации обнаружить не удаётся.
Отёком называется только увеличение объёма конечности или части тела, вызванное нарастанием количества интерстициальной жидкости. Важным следствием отёка является видимое на глаз увеличение размера конечности (её диаметра), сглаживание анатомических очертаний конечности или части тела.
Клинически отёки проявляются при наличии 3-7л избыточной жидкости в организме, а их появление зависит от массы тела и количества жировой ткани пациента [8,9].
При диагностике отёчного синдрома у обожжённых, как и при других отёчных синдромах важную роль имеет правильно собранный анамнез [18,19]: Когда впервые появились отёки? Уменьшаются ли отёка в ночное время или при смене положения тела или отдельной его части? Получал ли больной гормональные препараты (кортикостероиды, мужские и женские половые гормоны, антигипертензионные препараты –ß – Адреноблокаторы, блокаторы кальциевых канальцев, нестероидные противовоспалительные препараты (НПВП), антидепрессанты и др. Страдает ли обожжённый сахарным диабетом, изменился ли аппетит, масса тела или режим работы кишечника и мочевого пузыря?
Оценка клинических симптомов при отёчном синдроме проводится по бальной системе:
0 — отсутствие жалоб или увеличение окружности конечности на аналогичном уровне по сравнению со здоровой на 1 см;
1 — умеренная степень выраженности отёка: глубина ямки после надавливания до 1 мм или увеличение окружности на 2-3 см;
2 - значительная степень выраженности: глубина ямки 2 –3 мм или увеличение окружности на 2 – 5 см;
3 - чрезвычайно выраженный отёк: глубина ямки более 3 мм или увеличение окружности более 5 см
Для оценки наличия лишней жидкости в интерстициальной ткани проводится внутрикожная проба Олдрич — Мак-Клюра [4] – в толщу кожи ладонной поверхности предплечья вводят 0,2 мл физиологического раствора до образования волдырика. Учитывается срок, в течение которого он рассасывается. В нормальных условиях это происходит в пределах 50 – 90 мин. При наклонности к отёкам характерно значительное ускорение рассасывания волдырика вследствие гидрофильности кожи.
Наличие внутрисосудистой гипергидратации оценивается по гематокриту, либо по величине центрального венозного давления. Снижение гематокрита и уменьшение диуреза указывает на наличие отёков.
Для дифференциальной диагностики лимфатического отёка является признак Стеммера – кожу тыла П пальца стопы невозможно собрать в складку. При отёчном синдроме, вызванном другими причинами, этот симптом не встречается.
Накопление новой информации о патогенезе отёчного синдрома у обожжённых и неудовлетворённость полученными клиническими результатами заставляет продолжать поиск новых и более эффективных методов фармакологической профилактики и лечения отёков. Рациональное лечение отёчного синдрома у обожжённых подразумевает как этиотропную, так и патогенетическую и симптоматическую терапию. Знание механизмов развития отёка у обожжённых является важным при разработке эффективной терапии этих больных. Она должна быть направлена на нормализацию микроциркуляторных, макрогемодинамических нарушений, сосудисто-тканевой проницаемости, стабилизацию клеточных мембран, коррекцию соотношения онкотического и осмотического давления в тканях и крови, усиление выделения жидкости через почки. Для уменьшения последствий ишемизированных тканей применяются препараты, улучшающие реологические свойства крови или уменьшающие выраженность воспалительных изменений и отёк тканей. В последнее время предпочтительно назначают препараты, уменьшающие образование и ингибирующие свободные радикалы кислорода (сукцинатдегидрогеназу, каталазу, токоферол, витамин С, маннитол, вазопростан).
Раньше общепринятое лечение включало обязательное введение антибиотиков, реополиглюкина 2,5 мл/кг, 5 мл 1% пентоксифиллина в течение 3 – 5 суток после получения ожога. При появлении отёка конечностей и неврологических расстройств добавляли токоферол ( 1,0 30% раствора х3 раза в сутки), маннитол ( 400 мл 15% раствора), актовегин ( до 5,0), фуросемид (2 мл 2 раза в сутки) в течение 5-10 дней, прозерин (0,05% раствор 1 мл п/к). Эффект такого лечения кратковременный, возможны рецидивы.
В настоящее время считается оправданным в качестве профилактики развития отёчного синдрома у обожжённых использование форсированного диуреза в первые 3-5 суток после ожога, чтобы не дать возможности жидкости уйти в интерстициальное пространство. Для этих целей используется 2,4% раствор эуфиллина по 5-10 мл х 3 раза в день, мочегонные препараты.
Мочегонные препараты, которые традиционно применяются в нефрологической практике можно разделить на пять групп:
– препараты с умеренно выраженной активностью – группа тиазидов ( гидрохлортиазид);
– нетиазидные диуретики с умеренно выраженной активностью ( хлорталидон, индапамид, канефрон Н);
– высокоактивные диуретики – группа сульфамидов (фуросемид, торасемид), этакриновая кислота;
– калийсберегающие диуретики ( спиронолактон, амилорид, триамтерен);
– комбинации, включающие калийсберегающие диуретики с умеренной и высокой активностью [16].
Лечебный эффект салуретиков (фурасемида, этакриновой кислоты, гидрохлортиазида и др.) основан на уменьшении ОЦК за счёт чего снижается венозное давление. В связи с этим из отёчных тканей вследствие изменения гидростатического давления жидкость пассивно возвращается в сосудистое русло. Неплохо зарекомендовал себя для этих целей относительно новый препарат Трифас (торасемид), который жидкость из отёчных тканей вследствие изменения гидростатического давления пассивно возвращает в сосудистое русло. Трифас (торасемид) в 2-8 раз активнее фурасемида, рекомендован для лечения больных с отёчным синдромом различного генеза и артериальной гипертензии. Форма выпуска Трифас 20 – ампулы по 4 мл и Трифас 10 – таблетки. Дозировка Трифаса составляет от 0,1 мг/кг у детей до 0,5 мг/кг у взрослых. Доказано, что назначение трифаса больным, резистентным к фурасемиду, позволяет в 6 раз увеличить натрийурез, а диурез более чем в 2 раза [2, 15,16]. Кроме того, он обладает следующими преимуществами:
– стабильная биодоступность 80 – 90%, которая не снижается при хронической сердечной недостатосности;
– длительное действие и медленное привыкание;
– более высокая диуретическая активность;
– отсутствие “феномена рикошета”
– сильное калийуретическое действие;
– отсутствие ототоксичности;
– болем выражен эффект при цирротических асцитах, чем у фуросемида почти в 2 раза;
– пролонгированный эффект до 10 – 12 часов;
– при почечной недостаточности – фармакокинетика препарата не зависит от степени нарушения функции почек, не увеличиваются потери К+ и Са ++, что важно в период ожогового шока;
– при отеке лёгких.
У больных с декомпенсированной сердечно- легочной деятельностью обоснованным является применение дегидратационной терапии, которая включает в себя применение осмотических диуретиков. Эти препараты, в отличие от салуретиков вызывает активную дегидратацию тканей за счёт повышения осмолярности крови. Одним из представителей данной группы является шестиатомный спирт маннитол. Он является монофункциональным препаратом – помимо диуретического эффекта, другими фармакологическими свойствами не обладает. Быстрый и выраженный дегидратационный эффект маннитола используется с целью уменьшения отёка — набухания головного мозга при явлениях энцефалопатии и психозов у обожжённых, снижения внутрисердечного и внутриглазного давления, уменьшения экзо – и эндогенной интоксикации. Препарат вводят внутривенно в виде 5 – 10 – 15 – 20% раствора из расчета 0,5 – 1,5 г/кг в сутки [3].
Более перспективными являются препараты сорбилакт и реосорбилакт, созданные на основе гиперосмолярного (20%) раствора шестиатомного спирта сорбитола ( 200 г/л в сорбилакте и 60 г/л воды в реосорбилакте). Введённый в организм сорбитол быстро включается в общий метаболизм. При этом 85% сорбитола утилизируется в печени и накапливается в виде гликогена, пополняя энергетический резерв организма, что очень важно при обширных ожогах. Около 5% сорбитола депонируется в ткани мозга, сердечной мышце и только 10 – 12% выделяется с мочой. Высокая осмолярность сорбилакта формирует устойчивое повышение онкотического давления, а реосорбилакт имеет к тому же выраженные дезагрегатные свойства. Он обладает более мягким диуретическим эффектом по сравнению с маннитолом, яавляется многофункциональным препаратом, оказывающим воздействие на другие патогенетические механизмы отёчного синдрома у обожжённых. Он содержит натрия лактат, обладающий способностью корригировать кислотно – щелочное равновесие при ацидозе, что часто бывает при обширных ожогах.
При гипопротенемических отёках необходимо вначале повысить онкотическое давление плазмы крови, путём переливания альбумина, плазмы, гелофузина , а также переливание декстранов и осмолярных растворов – полиглюкин, реоглюман, сорбилакт и реосорбилакт. Затем назначают петлевой диуретик, например торасемид. При негипопротенемических отёках в качестве несущего раствора для введения торасемида используется кристалоид либо (предпочительнее) реосорбилакт, улучшающий одновременно реологические свойства крови.
В качестве профилактики и лечения общих и местных отёков(особенно отеков лица и отёков – набухания головного мозга) у обожжённых неплохо зарекомендовал себя 0,1% раствор L – лизина эсцината ( производства АО «Галычфарм», корпорация «Артериум»), действующим началом которого является тритерпеновый сапонин гликозида ß – амиринового типа эсцина и аминокислота L-лизина. При введении 5,0 – 10,0 мл L – лизина на 250,0 – 400,0 мл 0,9% раствора хлорида натрия сразу же при поступлении обожжённого в отделение позволял уменьшить скорость отека лица и набухание головного мозга, ускорить высыхание ожогового струпа, уменьшить период эксудации. Болевой синдром в месте ожога прекращался на вторые – третьи сутки. При ишемическом синдроме, который развивается при обширных ожогах, L – лизин эсцинат нормализует содержание АТФ в эндотелиоцитах, угнетает адгезию нейтрофилов, вызывает дозозависимое угнетение ферментативного и неферментативного ПОЛ. При этом его противоотёчное действие проявляется независимо от причинных факторов развития отёка ( механическая травма, ожоги, воспаление и т.д) [22].
В остром периоде отёчного синдрома и в послеоперационном периоде широко используется препарат Серта (серратиопептидаза) ( производитель Нью Лайф Фармасьютикале), являющийся протеолитическим ферментом, выделенным из непатогенной бактерии Serratia E14 и обладающий фибринолитической, противовоспалительной и противоотёчной активностью, уменьшающий боль вследствие блокировки высвобождения болевых аминов из воспалённых тканей. Серта не только тормозит развитие воспаления, но и создаёт благоприятные условия для быстрого снижения его активности путём элиминации деструктированных тканей, что способствует более быстрой ликвидации отёчного синдрома. Препарат особенно эффективен при лечении больных, у которых наблюдается развитие острых воспалительных процессов. Кроме того, серратиопептидаза способствует проникновению других препаратов, особенно НПВП, в зону воспаления, что приводит к уменьшению болевого синдрома [13]. Принимается Серта по 10 мг (1 таблетка) три раза в день после еды, запивая 100 – 150 мл воды, не разжёвывая таблетки. Длительность лечения от 3 до 20 дней, в зависимости от показаний [5].
Нами отмечено, что применение L - лизина эсцината в первые двое – трое суток с последующим переходом на приём Серты позволило уменьшить набухание – отёк головного мозга и таким образом снизить частоту энцефалопатий алкогольного и смешанного генеза, а в некоторых случаях после 3-5 дневного курса удавалось купировать алкогольный делирий.
Таким образом, знание патогенеза отёчного синдрома у обожжённых позволяет правильно диагностировать его причину и назначить патогенетическое лечение, что значительно улучшит непосредственные и отдалённые результаты лечения данной группы больных.
Литература:
1. Г.К.Болякина, Д.А.Еникеева, М.А.Каменская и др. Механизмы и возможные пути коррекции вторичных повреждений мозга // Новости науки и техники. Сер. Медицина. Вып. Реаниматология и интенсивная терапия.- 1997.-№2.- С. 11 – 21
2. Будущее петлевых диуретиков. // Therapia. Український медичний вісник.- 2006.-№1.- С. 70 –71
3. В.К. Гаврисюк, А.И. Ячник, Н.И. Гуменюк Хроническое легочное сердце: принципы диуретической терапии // Украинская медицинская газета.- 2006, №3, март.- С.23
4. Г.Я. Гуревич – Ильин Общая врачебная техника.- Медгиз.-М.1946.- С. 298
5. О. Доріченко Серта – нові горизонти ферментотерапії // Українська медична газета.- 2006.- №4, апрель.- С.23
6. И.А. Золотухин Что скрывается под маской отёчного синдрома? // Consiliummegicum. Журнал доказательной медицины для практических врачей.- 2005.-№ 11, том 07
7. И.А. Золотухин Что скрывается под маской отёчного синдрома?// Здоров’я України.-2006.-№11-12 (144 – 145, червень.- С. 39 –40
8. Д.Д. Иванов, С.В. Кушниренко Отёки в нефрологической практике: тактика лечения // Doctor , журнал для практикующих врачей.- 2006.-№2 (32),- С. 70-71
9. Д.Д. Іванов, С.В. Кушніренко Набряки в нефрологічній практиці. Тактика лікування // Українська медична газета.- 2006.-№7-8.- С.3
10. В.М. Оглоблига Современные основы патогенеза острой церебральной ишемии //Український журнал екстремальної медицини ім. Г.О. Можаева.-2005.-№2, том 6.- С. 81 –86
11. Н.П. Остапчук Отчёт о проведении клинических испытаний препарата Серта (таблетки), Киев.- 2005 .- 12с.
12. Патологическая физиология. Под редакцией Н.Н. Зайко .- Киев, «Вища школа».- 1977.- С.285
13. Рекомендации Европейской антиревматической лиги ( EULAR, 2003) // Ann.Rheum. Dis..- 2003.- V.63.- P.1145 –1155 - цит. Містецтво лікування.- 2006.-№2 (028), лютий.- С. 31 –32
14. Теория и практика интенсивной терапии. Под ред. Петера Ванги, перевод с венгерского.- Киев «Здоров’я». – 1983.- С.185
15. Трифас – новый петлевой диуретик в Украине // Новости медицины и фармации в мире.- 2006.-№ 05(187) С.-8
16. Трифас – эффективный петлевой диуретик. // Doctor, журнал для практикующих врачей.- 2006.0 №2 (32) апрель.- С.78
17. Л.В. Усенко, В.И. Слива, Ю.А. Площенко, А.А. Криштафор, М.В. Слива Отёчный синдром: современные возможности интенсивной терапии. // Медицина неотложных состояний.- 2006.- № 1(2).- С.21 –27
18. О. Шушляпин, Л. Кононенко Отёчный синдром в практике семейного врача. Дифференциальная диагностика отёчного синдрома // Ліки України.- 2005,- №9, вересень.- С. 19 – 24
19. О. Шушляпин, Л. Кононенко Отёчный синдром в практике семейного врача. Патогенетическая терапия // Ліки України.- 2005,- №10, жовтень.- С. 8 – 10
20. Bnummuller M. Der Einzatz van hydrolytisehen Enzymen bei stumpfen Weichteirverletzungen und Spunggelenksdistorsionen //Allgemeinmedizin.1990.- 19.- S. 178 –184
21. Esch P.M., Gemgross H., Fabian A. Reduction of postoperative swelling. Objective measurement of evelling of the upper ankle joint in treatment with Serapertase – a prospective Studi ( German). Fortsehr Med., 1989; 107(4); S. 67 – 68, 71 –72
22. Frick R.W. Three treatment for chronic venous insufficiency: escin, hydroxyethylrutoside, and Daflon // Angiology.- 2000/- Mar.: 51(3).- P.197 205
Designed by Сайт на Заказ