ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Раннее хирургическое лечение субфасциальных электроожогов
Фисталь Э.Я.
Штутин А.А.
Самойленко Г.Е.
Солошенко В.В.
Институт неотложной и восстановительной хирургии АМН Украины, Донецк.
Эффективное раннее хирургическое лечение ожогов IV степени имеет несомненное значение ввиду особой тяжести их клинического течения, гибели глубоких анатомических структур, большой частоты осложнений и функциональных нарушений.
Одним из важнейших направлений повышения качества реабилитации пострадавших с субфасциальными ожогами является разработка и совершенствование методов закрытия дефектов тканей. Принимая во внимание особенности электроожогов, в частности, их полифокальность, поражение сосудов на значительном протяжении, тяжесть состояния пострадавших, определенные преимущества принадлежат ротационным, в том числе «островковым», трансплантатам, так как продолжительность и травматичность таких оперативных вмешательств существенно меньше, а надежность прогнозируемого эффекта существенно выше, чем при микрососудистой пересадке комплекса тканей. В то же время задача определения показаний к данной группе пластических вмешательств, роль трансплантатов с осевым кровотоком в патогенезе и течении раневого процесса остаются не полностью разрешенными.
Материалы и методы
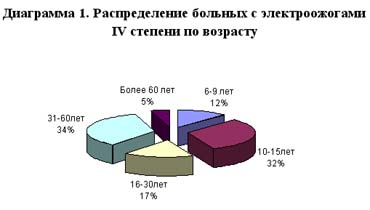
Нами изучены результаты комплексного лечения 66 пострадавших от высоковольтных электрических повреждений различной тяжести, с наличием поражения субфасциальных структур конечностей, головы, туловища в возрасте от 6 до 64 лет, находившихся на лечении в отделе термических поражений и пластической хирургии Института неотложной и восстановительной хирургии АМН Украины с 1996 по 1999г.г. (Диаграмма 1)
Диаграмма 1
Как видно, взрослые и дети, пострадавшие в результате высоковольтных ожогов, распределились примерно поровну. Наиболее опасным местом возникновения высоковольтных электроожогов являются открытые трансформаторные здания. Попытка добычи цветного металла из них или вырубка кабеля — одна из причин роста высоковольтных ожогов за последние 3 года у взрослых и у подростков.
Для реализации поставленной цели нами были проведены клинико-инструментальные, морфологические и экспериментальные исследования, направленные на уточнение некоторых особенностей течения раневого процесса при субфасциальных ожогах.
Экспериментальные исследования были проведены на 104 крысах-самцах линии Вистар. В условиях нембуталового наркоза моделировали ожоговую субфасциальную рану. В исследуемой группе (32 животных) замещение дефекта производили путем перемещения лопаточного мышечного лоскута. В сравнительном аспекте оценивали уровень pO2 транскутанным датчиком ТСМ-2 («Radiometer»), морфометрически оценивали состояние микроциркуляторного русла в лоскуте и реципиентной зоне, изучали сроки заживления раны в исследуемой и контрольной группах. Экспериментальные исследования показали восстановление диаметра микрососудов до контрольного уровня в зоне аутотрансплантации лоскута к 10 суткам после операции. Сопоставление с исследованиями контрольной группы выявило увеличение внешнего диаметра артериол на 33,5% и внутреннего на 77,3%, что отражает оптимизацию транспортных процессов в трансплантате и может расцениваться в качестве свидетельства непрямой реваскуляризации зоны ожоговой раны, обусловленной привнесением трансплантата с наличием адекватного осевого кровообращения.
Морфологический анализ биоптатов мышц, нервов и кости на периферии ожоговой раны в зоне паранекроза показал, что во всех перечисленных структурах отмечается сочетание процессов некроза, дистрофии, раздражения и регенерации. Следует подчеркнуть, что большая часть тканей сохраняет способность к спонтанной регенерации при условии существования в благоприятной биологической среде.
Исходя из полученных данных, мы пришли к заключению, что применение трансплантатов с осевым типом кровообращения в наибольшей мере соответствует требованиям оптимизации течения раневого процесса при субфасциальном поражении.
В рамках исследования проведена оценка клинико-лабораторных показателей бактериологического, цитологического исследования, определение рН раневого отделяемого на этапах раннего хирургического лечения.
Полученные результаты и их обсуждение
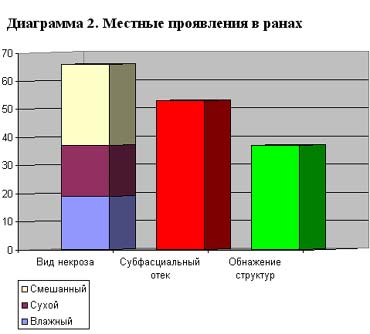
Для уточнения патогенеза раневого процесса, нами в исследуемой группе изучены особенности образования струпа, ранних воспалительных реакций и вовлечения в процесс глубоких структур (Диаграмма 2).
Образование смешанного или первично влажного некроза при электроожогах обусловлено не только коагуляцией вследствие экзотермической реакции в тканях, но и первичным микротромбообразованием с последующей прогрессирующей ишемией, приводящей к перераспределению клеточной и внеклеточной жидкости с интерстициальным пропитыванием.
Диаграмма 2
Клиника нарастания местного отека при электроожогах возникала уже спустя 3-4 часа после травмы. Отёк развивался по типу субфасциального, что сопровождалось прогрессированием капилляростаза вплоть до некроза непоражённых первично структур. Зачастую при высоковольтных электроожогах происходит первичное тромбообразование в магистральных сосудах с последующей гангреной конечности. Характерно, что при подобных повреждениях первая фаза воспаления практически всегда завуалирована и внешне рана выглядит сухой почти без отделяемого. Опасность подобного мнимого благополучия в ранах должна быть известна и настораживать хирургов, а принимаемые меры по декомпрессии тканей путём некро-фасциотомии должны быть адекватными и своевременными.
На более поздних стадиях выраженность местного отека была прямо пропорциональна развитию воспаления и проявляется как результат распространения зоны гиперемии (полнокровия). По мере высыхания некротического струпа при циркулярных поражениях, развивается странгуляционный компонент, что также требует немедленного рассечения струпа.
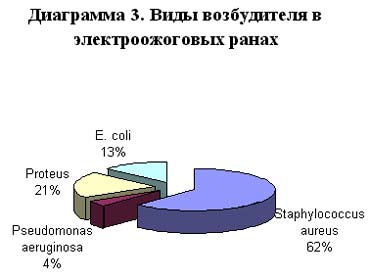
Микрофлора ожоговых ран была представлена, как правило, ассоциациями условно-патогенных грамположительных и грамотрицательных микроорганизмов. Чаще всего выделяли ассоциацию стафилококка и штаммов синегнойной палочки, продуцирующих бета-лактамазы, с энтерококками, протеем, кишечной палочкой. Основными возбудителями ожоговой инфекции являлись S. aureus и P. aeruginosa с характерным для последних лет возрастанием роли синегнойной палочки (Диаграмма 3). Если в первые дни болезни в ране вегетирует грамположительная кокковая флора, то в последующем присоединяется грамотрицательная флора, во многом определяющая течение раневого процесса и ожоговой болезни.
Диаграмма 3
На современном этапе высокая антибиотикоустойчивость возбудителей ожоговой инфекции затрудняет подбор средств местной и общей антибактериальной терапии особенно при микробной инвазии госпитальными штаммами микроорганизмов, сопровождающейся развитием тяжелых местных и общих инфекционных осложнений, часто ведущих к гибели больных.
Характеристику состояния раны после иссечения некроза оценивали методом мазков-»отпечатков». Нами проведена оценка мазков-»отпечатков» у 58 обожженных спустя 3-5 дней после некрэктомии, при подготовке к отсроченной свободной аутодермопластике с использованием препарата Betadine 10%, и сопоставлен исход пластической операции.Особенность клеточного состава отпечатков состояла в большем относительном содержании нейтрофильных гранулоцитов (2/3 — 3/4 поля зрения) в препарате (рис. 1).
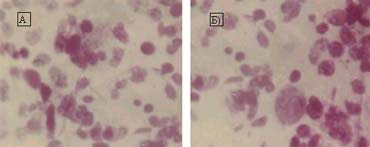
Рисунок 1.
а) Мазок — отпечаток с неудовлетворительным типом цитограммы: большое количество дегенеративных форм нейтрофилов, отсутствие фагоцитоза, внеклеточное расположение бактерий;
б) Мазок — отпечаток с удовлетворительным типом цитограммы: наличие зрелых фагоцитирующих клеток, отсутствие внеклеточно находящихся бактерий, появление и созревание полибластов.
Результатом наших исследований явился вывод, что не количественный, а качественный состав клеток, а именно их более зрелых форм, определяющих состояние фагоцитоза, — является прогностически значимым критерием положительной динамики репаративных процессов в ране, что позволило производить пластическое закрытие ран не ожидая «хорошей» картины в цитограмме.
Срок выполнения пересадки сложных лоскутов играет важную роль в предотвращении вторичного некроза глубоких структур и достижения их реваскуляризации. Своевременно и успешно проведенные операции зачастую позволяли избежать необходимости реконструктивных вмешательств в дальнейшем. Таким образом, несвободная кожная аутопластика, выполненная в раннем сроке после ожога, принимает черты реконструктивно-восстановительной операции.
Мы придерживаемся принципа, что восстановление дефекта, вызванного термической коагуляцией и сопровождающейся ишемизацией тканей (как одним из важнейших факторов в патогенезе электротравмы или длительного сдавления нагретым предметом), должно производиться в ранний срок одним из полнослойных лоскутов, преимущественно имеющих осевой тип кровоснабжения. Это позволяет надеяться на феномен реваскуляризации, а точнее — относительной гипероксидации тканей, находящихся в состоянии острой или подострой ишемии.
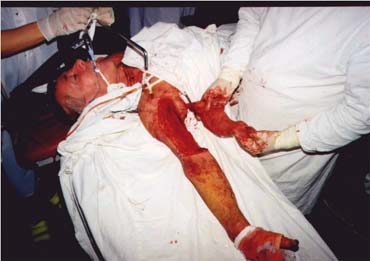
Рисунок 2.
Пластика дефекта островковым лоскутом широчайшей мышцы спины
В ранний срок целесообразым было использование первичной несвободной аутодермопластики при ожогах ограниченных (до 5 %п.т.), не сопровождавшихся развитием ожоговой болезни (20 из 21 операции), тогда как отсрочить вмешательство приходилось у 7 из 11 больных.
Методика использования местных пластических ресурсов применена в 44 случаях, из них в 31 сочетаясь со свободной пересадкой расщепленной аутокожи. Для окончательной ликвидации ран после первичной несвободной пластики потребовалось четырежды использовать один из методов пересадки полноценных тканей повторно. Кроме того, выполнено две некрэктомии, одна остеонекрэктомия и 13 свободных пересадок расщепленных лоскутов аутокожи.
С целью восстановления целостности покровов после использования методики отсроченной несвободной кожной пластики пришлось произвести 27 операций: 6 остеонекрэктомий (из них две — фрезевые), одну некрэктомию и одну секвестрэктомию, а также четыре несвободных и 15 свободных пересадок кожи. При высоковольтной электрической травме срок лечения составил в среднем 41,25+5,97 дня. Полнослойное покрытие являлось по сути этапом реконструктивно-восстановительного возмещения массивных тканевых потерь уже после удаления необратимо измененных структур. Однако и в этом случае вмешательство не должно откладываться на длительный срок во избежание развития вторичных изменений на фоне микроциркуляторных расстройств.
Если зона первичного некроза оказывалась шире, чем это было выявлено при иссечении, то демаркационное отторжение продолжалось и под пересаженным кожно-фасциальным лоскутом. Однако возможно раннее местное использование 10% раствора «Бетадин R» позволяло локализовать процесс, что способстовало быстрой санации и не препятствовало приживлению кожных аутолоскутов на других участках. Ускорить санацию позволила методика активного проточно-аспирационного дренирования.
Показаниями к использованию лоскутов с осевым кровотоком (в срок до 3-10 суток) считали глубокие, ограниченные по площади до 2-3%п.т., поражения жизненно и функционально важных областей — лица и свода черепа, крупных суставов, а также изолированные глубокие поражения предплечья, кисти и стопы.
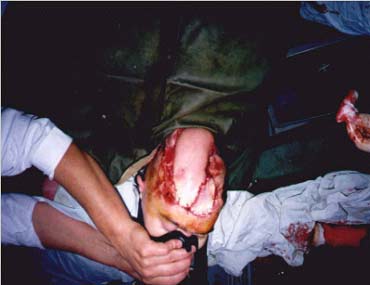
Рисунок 3.
Пересадка кожно-мышечного лоскута широчайшей мышцы спины в проекцию саггитального синуса
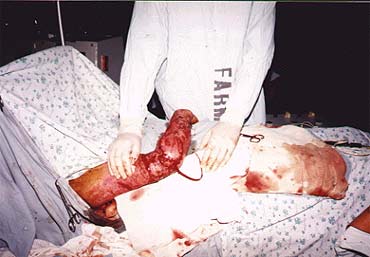
Рисунок 4. Пластика дефекта в области локтевого сустава лучевым лоскутом на антеградном кровотоке
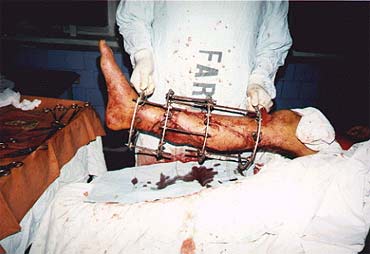
Рисунок 5. Пластика дефекта голени икроножным лоскутом с одновременным наложением аппарата наружной костной фиксации
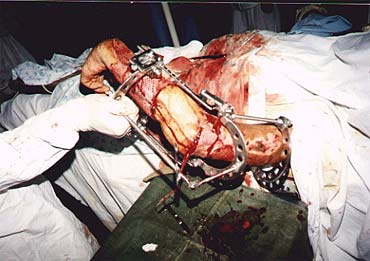
Рисунок 6. Пластика дефекта локтевой области лечевым лоскутом с наложением аппарата Волкова-Оганесяна
Важной характерной чертой в подходе к лечению этой группы пострадавших являлась необходимость индивидуального выбора методов оперативных вмешательств, их сроков и очередности. Отсрочить вмешательство приходилось: 1) при неустойчивой гемодинамике 2) наличии раневого дефекта, превышающего безопасные донорские возможности оперируемой зоны, 3) наличии обширного перифокального ожогового поражения меньшей глубины. 4) сопутствующем атеросклеротического или диабетического процесса.
Выбор вида трансплантата определялся в зависимости от функционально-эстетического соответствия реципиентной и донорской областей.
Полноценные пластические ресурсы использованы у 44 пострадавших. Следует особо подчеркнуть, что у 6 пациентов использовали по 2-3 осевых трансплантата, пересаженных одномоментно или за 2 операции.
Полное приживление лоскутов было достигнуто в 93% наблюдений. Некроз трансплантатов развился у 7% ( 3 больных) в основном после микрососудистой пересадки комплексов тканей. Использование трансплантатов с осевым кровотоком во всех случаях позволило сохранить пострадавшие конечности и сократить сроки лечения в 2,1 раза.
Применение современных методов пластики глубоких дефектов при поражениях IV степени с использованием трансплантатов с осевым типом кровообращения характеризуются одноэтапностью реконструкции, высокой устойчивостью к инфекции, полноценностью воссоздаваемого кожного покрова, высокими возможностями первичных и отдаленных реконструктивных вмешательств на глубоких анатомических структурах. Таким образом, их широкое применение в клинике, сочетание с традиционными методами кожно-пластических вмешательств позволяет значительно повысить эффективность лечения и реабилитации пострадавших.
Designed by Сайт на Заказ