ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Динамика растворимой формы CD38 в плазме больных с ожоговой болезнью
Лебедев М.Ю.
Крыжанова М.А.
Кораблев С.Б.
Барышников А.Ю.
Новиков В.В.
НИИ травматологии и ортопедии,Г.Н.Новгород
НИИ эпидемиологии и микробиологии, Г.Н.Новгород
Институт экспериментальной терапии опухолей, г.Москва.
CD38 — мультифункциональный мембранный поверхностный гликопротеин, который экспрессируется различными клетками, включая Т- и В- лимфоциты на определенных этапах их развития [3]. CD38 функционирует и как трансмембранный рецептор передачи сигнала трансдукции, и как внеклеточный фермент. Кроме того, определена его роль в процессе адгезии лимфоцитов к эндотелию сосудов [12].
В качестве трансмембранного рецептора CD38 может передавать как положительные, как и отрицательные сигналы, регулирующие пролиферацию и дифференцировку Т- и В -лимфоцитов [5]. Есть сведения о том, что моноклональные антитела (МКА) к CD38 и лиганд CQ38 обладают свойством, при определенных условиях, стимулировать или предотвращать апоптоз лимфоцитов у человека [9]. Среди других эффектов лиганда CD38 отмечают активацию киназ и фосфорилирование белков [10].
Внеклеточная часть молекулы CD38 функционирует как фермент, который катализирует синтез и гидролиз циклической АДФ-рибозы, которая недавно идентифицирована как мощный Са2+ мобилизирующий агент [8]. Ферментные функции CD38, вероятно, имеют иммунорегуляторное значение [13] . Хотя до конца непонятно, как циклическая АДФ-рибоза, которая является типичной внутриклеточной молекулой передачи сигналов, проявляет свое действие, если она синтезируется вне клетки [11].
Наряду с мембранной формой антигена CD38 клетки продуцируют растворимый CD38 (pCD38), имеющий молекулярную массу 39 kDa. Он способен связываться с МКА против CD38 и растворимым CD31 антигеном (120-130 kDa), который выступает в качестве лиганда CD38 [6], [8]. Считается, что по своему функциональному предназначению pCD38 подобен мембранному CD38 антигену [13]. Кроме того, существуют данные, свидетельствующие в пользу того, что pCD38 может выполнять регуляторные функции в межклеточных взаимодействиях в норме и при различных патологических состояниях [7], [14].
Целью настоящего исследования явилось изучение содержания растворимого CD38 антигена у пациентов с развившейся ожоговой болезнью.
Материалы и методы
Кровь для исследования брали у пациентов в утренние часы после приема пищи. Использовали гепаринизированную (5 ЕД/мл) кровь, взятую из периферической вены либо из катетера. Кровь центрифугировали при 200 g 15 минут. Полученную плазму хранили в холодильнике при температуре — 20° С. Максимальный срок хранения составлял 5 месяцев. В качестве контроля исследовали сыворотку здоровых доноров.
Было обследовано 16 больных, проходивших лечение в Российском ожоговом центре на базе Нижегородского НИИ травматологии и ортопедии. Возраст пациентов от 16 до 67 лет. Площадь ожоговых ран от 15 до 85 % поверхности тела. Сроки нахождения пациентов в стационаре от 8 суток до 3 месяцев. У двух пациентов наблюдался неблагоприятный исход ожоговой болезни.
Содержание растворимого CD38 антигена определяли иммуноферментным методом с помощью поликлональных антител против поверхностных антигенов мононуклеарных клеток периферической крови здоровых доноров и моноклональных антител ИКО-20, направленных против CD38 антигена. [1]. Очищенные с помощью сульфата аммония и ионообменной хроматографии на ДЕАЕ-целлюлозе козьи поликлональные антитела против поверхностных антигенов мононуклеарных клеток сорбировали в лунки планшетов для иммуноферментного анализа в течение 16-18 час при 4 — 8°С. После отмывания несвязавшихся антител в лунки наносили образцы исследуемых сывороток в разведении 1:10 с последующей инкубацией планшетов в течение 1 часа при комнатной температуре и отмывкой несвязавшихся белков. Затем лунки планшетов в тех же условиях последовательно обрабатывали рабочим раствором очищенных моноклональных антител ИКО-20 и козьими антителами против иммуноглобулинов мыши, конъюгированными с пероксидазой хрена. Для каждой тестируемой сыворотки ставили отрицательный контроль, где вместо моноклональных антител лунки планшетов обрабатывали раствором поликлональных мышиных иммуноглобулинов в той же концентрации, что и моноклональные антитела. После заключительного отмывания несвязавшегося конъюгата реакцию проявляли раствором 0,1% ортофенилендиамина в 0,05 М цитратном буферном растворе рН 5,0, содержащем 0,01% перекиси водорода. Реакцию останавливали 1М раствором H2S04. Учет результатов проводили с помощью фотометра КАИЦ-01 при длине волны 492 нм. Результаты выражали в условных единицах. В качестве положительного контроля, служащего стандартом, использовали сыворотку крови больного ревматоидным артритом, содержание pCD38 антигена в которой принимали за 300 условных единиц.
Одновременно для оценки состояния клеточного иммунитета методом непрямой иммунофлуоресценции определяли количественное содержание субпопуляций Т-лимфоцитов. Исследования проводили с помощью моноклональных антител ИКО-90, направленных против антигена CD3 (Т-лимфоциты), ИКО-86 — против CD4 (Т-хелперы) и ИКО-31 — против CD8 (цитотоксические Т-лимфоциты) [1]. Количество антиген-положительных клеток выражали в процентах. Рассчитывали иммунорегуляторный индекс (соотношение CD4+/CD8+ клеток). Кроме того, определяли количество Е-РОК (CD2+ клетки), методом розеткообразования с эритроцитами барана по К.А. Лебедеву [2].
Статистическую обработку полученных результатов проводили по методу Фишера , с помощью программы «STADIA».
Результаты и обсуждение
С помощью разработанного авторами иммуноферментного метода с применением моноклональных и поликлональных антител определяли содержание растворимого CD38 антигена в плазме у пациентов с термическим поражением в различные сроки от момента травмы. Среднее содержание растворимого CD38 антигена при ожоговой болезни составило 115+27,93 условных единиц и не имело статистически достоверных различий с содержанием pCD38 антигена в сыворотке доноров.
|
Таблица 1 |
|||||
|
Показатель |
Норма (здоровые доноры) n=26 |
Сроки от момента получения ожоговой травмы (сутки) |
|||
| 1 — 3 (n=5) | 4 -14 (n=14) | 15 — 30 (n=6) | |||
| рСD38(УЕ) | 121 +/- 7,8* | 135,4 +/- 11,4** | 66,21 +/- 12,53*** | 124,16 +/- 31,58 | |
| CD3(%) | 54,5 +/- 7,0 | 61 +/- 4,69** | 29,0 +/- 9,77** | 40,53 +/- 12,07 | |
| CD4 (%) | 29,3 +/- 2,52* | 20,67 +/- 3,3** | 11,2 +/- 2,2*** | 18,83 +/- 5,47 | |
| CD8 (%) | 20,7 +/- 6,11 | 25,8 +/- 13,2 | 14,1 +/- 5,76 | 22,33 +/- 8,53 | |
| CD4/CD8 | 1,53 +/- 0,24* | 0,8 +/- 0,71* | 0,79 +/- 0,15* | 0,84 +/- 0,18* | |
| CD2 (%) | 40-65*** | 34,8 +/- 1,59 | 37,0 +/- 2,17 | 31,4 +/- 2,67 | |
* — статистически достоверные различия между донорами и пациентами с ожоговой болезнью (р < 0.002)
** — статистически достоверные различия в различные сроки от момента травмы (р < 0.05)
*** — приводится норма по Лебедеву К.А.[2]
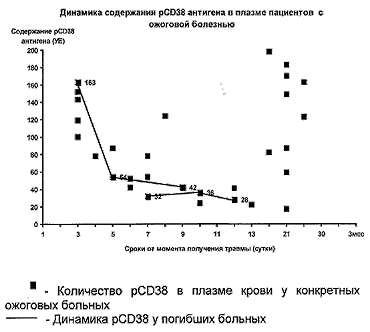
Вместе с тем, при анализе уровня pCD38 антигена в плазме пострадавших на разных сроках от момента травмы (табл. 1) было выявлено, что, начиная с четвертых-пятых суток и до третьей недели (период острой ожоговой токсемии) содержание pCD38 антигена значительно снижалось. К третьей неделе уровень pCD38 начинал постепенно восстанавливаться. При этом содержание pCD38 антигена в данный период отличалось большим разбросом (рис.1)
Изменения в содержании pCD38 в плазме пациентов коррелировали с динамикой количества CD3+ , CD4+ и CD8+ лимфоцитов, относительное содержание которых в периферической крови также снижалось в указанные периоды. Особенно это относится к CDЗ+ лимфоцитам, относительное количество которых в период с 4 по 14 сутки от момента травмы снижалось более чем в два раза. В дальнейшем происходило увеличение содержания CDЗ+ клеток. Полученные результаты соответствуют данным других авторов [4]. Иммунорегуляторный индекс (соотношение CD4+ и CD8+ клеток) был снижен на протяжении всего периода проведения исследований и не менялся в разные сроки от момента получения ожоговой травмы. Снижение популяций CD3+ CD4+ и CD8+ лимфоцитов, а также снижение иммунорегуляторного индекса обычно расценивают как признак грубых нарушений в клеточном звене иммунной системы, приводящих к иммуносупрессии у ожоговых больных. В то же время нужно заметить, что изменений в экспрессии лимфоцитами CD2 антигена не выявлено. Уровень CD2+ лимфоцитов на протяжении ожоговой болезни практически не изменялся и был незначительно снижен по сравнению с региональной нормой [3].
Из наблюдавшихся 16 пациентов двое пострадавших умерли. В обоих случаях динамика содержания pCD38 антигена имела отрицательный характер (рис.1). При последнем прижизненном исследовании у обоих больных уровень pCD38 антигена в плазме был значительно ниже нормы. При этом следует отметить, что смерть наступила в стадию острой ожоговой токсемии, когда содержание pCD38 было снижено у всех наблюдавшихся пациентов. В период острой токсемии низкий уровень pCD38 у всех пациентов сопровождался низкой экспрессией CD3, CD4 и CD8 антигенов. В качестве иллюстрации предлагаются два клинических примера с различными исходами ожоговой болезни.
Больной Ю., ист.бол. №183886. Травма 07.11.1998 г. Диагноз: ожог пламенем ШАБ-IV степени головы, шеи, туловища, правой верхней и нижней конечности на площади 35% поверхности тела (из них ШБ-IV степени — 30%); ожог верхних дыхательных путей; сотрясение головного мозга; тяжелый ожоговый шок. Уровень pCD38 в плазме: 10.11.98 -163 усл. ед. (СDЗ+ клетки — 25%, CD4+-клeтки — 13%, CD8+ клетки — 20%); 12.11.98 — 54 усл. ед (СОЗ+- клетки — 22%, CD4+-клетки — 5%, CD8+- клетки — 7% ); 16.11.98 — 42 усл. ед (СDЗ+- клетки — 23%, CD4+- клeтки — 7%, CD8+- клeтки — 14%). Несмотря на проведенную интенсивную терапию, больной умер 18.11.1998 в 6 ч утра.
Больная Б., ист. бол. № 182068. Травма 03.07.1998 г. Диагноз: ожог кипятком и паром II-IIIA степени туловища, верхних и нижних конечностей на площади 35% поверхности тела; тяжелый ожоговый шок. Уровень pCD38 в плазме 06.07.1998 г. -100 усл.ед. (СDЗ+- клетки — 72%, CD4+- клeтки -15%, СD8+- клетки — 34%). 09.07.1998 г. уровень pCD38 — 52 усл. ед. (СDЗ+- клетки — 42%, CD4+- клeтки — 10%, СD8+- клетки -35%); 16.07.1998 -198 усл. ед. (СDЗ+- клетки — 52%, CD4+-клeтки — 32%, CD8+- клeтки — 26%). Больной проводили комплексное лечение, в результате которого кожный покров был полностью восстановлен. 24.07.1998 г. больная выписана на амбулаторное лечение.
Из приведенных примеров видно, что, несмотря на различный исход ожоговой болезни, изменения содержания pCD38 антигена и СDЗ+, CD4+ и CD8+ клеток имели схожий характер.
Таким образом, содержание растворимой формы CD38 антигена в плазме крови у пациентов с термической травмой изменяется в зависимости от стадии течения ожоговой болезни. Стадия острой токсемии характеризуется низким содержанием pCD38 антигена в крови. На стадии септикотоксемии содержание pCD38 постепенно восстанавливается. Количество pCD38 антигена и cодержание в периферической крови CD3+, CD4+ и CD8+ клеток изменяются одновременно и однонаправленно. Можно заключить, что растворимый CD38 антиген, являющийся представителем недавно обнаруженного класса иммунорегуляторных молекул, служит информативным показателем состояния клеточного звена иммунной системы у пациентов с ожоговой болезнью, а оценка его содержания может быть использована для определения выраженности иммуносупрессии.
Список литературы
- Барышников А.Ю., Тоневицкий А.Г. Моноклональные антитела в лаборатории и клинике. — М., 1997. — 212 с.
- Лебедев К.А., Понякина И.Д., Авдеева В.С., Чернобровый В.Ф. Отбор и реабилитация людей с хронической интоксикацией и иммунной недостаточностью, поживающей в экологически неблагополучных районах и зонах экологических катастроф России: Методические рекомендации. — Москва-Иваново ,1993, 8-15 с.
- Хаитов P.M., Пинегин Б.В., Истамов Х.И. Экологическая иммунология.- М., 1995 — 57 с.
- Alessio М., Roggero S., Funaro A., De Monte L.B., Peruzzi L., Geuna M., Malavasi F. CD38 molecule: structural and biochemical analysis on human Т lymphocytes, thymocytes, and plasma cells // J lmmunol.-1990.-V.145,N3-P.878-884.
- Barlow Y. Т. lymphocytes and immunosuppression in the burned patient: a review//J Burns.-1994.-V.20,N6.-P.487-490
- Ferrero E., Malavasi F. Human CD38, a leukocyte receptor and ectoenzyme, is a member of a novel eukaryotic gene family of nicotinamide adenine dinucleotide+-converting enzymes: extensive structural homology with the genes for murine bone marrow stromal cell antigen 1 and aplysian ADP-ribosyI cyclase // J lmmunol.-1997.-V.159,N8.-P.3858-3865
- Funaro A., Horenstein A.L., Calosso L., Morra M., Tarocco R.P., Franco L., De Flora A., Malavasi F. Identification and characterization of an active soluble form of human CD38 in normal and pathological fluids // Int Immunol.- 1996.-V.8,N11.-P.I 643-1650
- Horenstein A.L., Stockinger H., Imhof B.A., Malavasi F. CD38 binding to human myeloid cells is mediated by mouse and human CD31 // Biochem J.- 1998.-V.330 ( Pt 3)-P.1129-1135
- Howard M., Grimaldi J.C., Bazan J.F., Lund F.E., Santos-Argumedo L., Parkhouse R.M., Walseth T.F., Lee H.C. Formation and hydrolysis of cyclic ADP-ribose catalyzed by lymphocyte antigen CD38 // Science.-1993.-V.262:5136.-P. 1056-1059
- Lijima N., Miyamura К., Itou T., Tanimoto M., Sobue R., Saito H. Functional expression of Fas (CD95) in acute myeloid leukemia cells in the context of CD34 and CD38 expression: possible correlation with sensitivity to chemotherapy // Blood.-1997.-V.90,N12.-P.4901-4909
- Kitanaka A., Ito C., Coustan-Smith E., Campana D. CD38 ligation in human В cell progenitors triggers tyrosine phosphorylation of CD19 and association of CD19 with lyn and phosphatidylinositol 3-kinase // J Immunol.- 1997.-V.159.N1.-P. 184-192.
- Lund F.E., Cockayne D.A., Randall T.D., Solvason N., Schuber F., Howard M.C. CD38: a new paradigm in lymphocyte activation and signal transduction // Immunol Rev.-1998.-N.161.-P.79-93
- Malavasi F., Funaro A., Roggero S., Horenstein A., Calosso L., Mehta K. Human CD38: a glycoprotein in search of a function // Immunol Today.-1994.-V. 15,N3.-P. 95-97.
- Mallone R., Ferrua S., Morra M., Zocchi E., Mehta K., Notarangelo L.D., Malavasi F. Characterization of a CD38- like 78-kilodalton soluble protein released from В cell lines derived from patients with X-linked agammaglobulinemia // J Clin lnvest-1998.-V.101,N12.-P.2821-2830.
Designed by Сайт на Заказ