ОБЪЕДИНЕНИЕ КОМБУСТИОЛОГОВ
«МИР БЕЗ ОЖОГОВ»
Рациональная антибактериальная терапия у детей с термической травмой
Марковская О.В.
Штукатуров А.К.
Насонова Н.П.
Детский ожоговый центр ДГКБ № 9, г. Екатеринбург.
Рост резистентности госпитальных штаммов микроорганизмов остается острой проблемой в ожоговых центрах России (Крутиков М.Г., 2004, Страчунский Л.С., 2003). Летальность пациентов с неадекватной антибактериальной терапией более чем в 2 раза выше, чем с адекватной (61,9 и 28,4% соответственно) (Белобородов В.Б., 2003, Руднов В.А., 2002). Это заставляет искать разумные подходы к оптимизации схем антибиотикотерапии и антибиотикопрофилактики у больных с термической травмой.
Внутрибольничные инфекции являются в настоящее время одной из основных причин заболеваемости и смертности госпитализированных больных, приводящей прямо или косвенно к резкому увеличению стоимости лечения. Выборочные исследования, проведенные на различных территориях нашей страны, свидетельствуют о значительном распространении внутрибольничных инфекций, большом медицинском и социально-экономическом ущербе, наносимом ими (Страчунский Л.С., 1997, Руднов В.А., 1999, Зайцев А.А., 2003, Яковлев С.В., 2004). Особую актуальность эта проблема приобретает в ожоговых стационарах, где сам механизм травмы предрасполагает к проведению нескольких, и далеко не всегда оказывающихся эффективными, курсов антибактериальной терапии. Все это определяет актуальность проблемы внутрибольничных инфекций и рациональной антибиотикотерапии у ожоговых пациентов.
Следует учитывать, что этиологическая структура и особенности эпидемиологии внутрибольничной инфекции в ожоговом стационаре зависит как от профиля и специализации учреждения в целом, так и возрастных особенностей пациентов, их социального статуса, преморбидного фона, специфики методов, средств лечения и обследования больных и ряда других факторов. В ОРИТ частота госпитального инфицирования достигает 20-25%. В Свердловской области официально зарегистрировано 9,5% случаев ВБИ, но фактически этот показатель должен быть в 10-40 раз выше.
Тем не менее, наиболее ценными для каждого конкретного стационара являются именно локальные данные по микробиологическому пейзажу и антибиотикочувствительности. Такие исследования проводятся в ГДКБ №9, а в частности, в детском ожоговом центре, уже на протяжении не менее 10 лет и позволяют оценить не только динамику чувствительности возбудителей важнейших нозокомиальных инфекций к имеющимся в клинике антибактериальным препаратам, а так же и саму динамику преобладания возбудителей в той или иной среде в конкретный временной интервал, и идентифицировать флору, заселяющую палату, оборудование, рабочие поверхности и другие предметы, контактирующие прямо или опосредованно с пациентом в реальной рабочей обстановке.
Наибольшую опасность в качестве источников инфекции для ожогового больного представляет медицинский персонал из числа длительных носителей и больных стертыми формами, а также длительно находящиеся в стационаре больные, которые часто являются носителями внутрибольничных штаммов. К сожалению, далеко не каждый стационар имеет возможность скринингового исследования на носительство патогенной и условно-патогенной флоры. Процесс переноса инфекции опасен и для персонала, особенно детских клиник.
Следует отметить увеличение «агрессивности» современной медицины, обусловленное увеличением числа инвазивных лабораторных исследований и лечебно-диагностических манипуляций, выполняемых пациенту в процессе лечения, что существенно увеличивает роль и эпидемиологическое значение «артифициального» (искусственного) механизма передачи возбудителей инфекционных болезней в условиях стационара.
Реализация «артифициального» механизма передачи ВБИ возможна посредством оперативных вмешательств и перевязок, переливания крови и ее компонентов, инъекций лекарственных препаратов, в т. ч. инфузионных при катетеризации центральных вен, методов гравитационной хирургии крови. Искусственная вентиляция легких и энтеральное зондовое кормление и постоянная катетеризация мочевыводящих путей также «прокладывают» дорогу для госпитальной флоры у ожоговых пациентов. Все вышеперечисленные современные методы диагностики и лечения, безусловно, обоснованы серьезными научными достижениями в области технического прогресса, и применение их в практической медицине оправдано. Тем не менее следует помнить, что ожоговый больной – это пациент с тяжелым вторичным иммунодефицитом и его восприимчивость к госпитальной флоре особенно высока.
Входными воротами для госпитальной инфекции у обожженных становятся ожоговая поверхность, катетеризированные магистральные сосуды, дыхательные пути, пищеварительный тракт, мочевыводящие пути. Это связано не только с инвазивностью терапии, но и с потерей естественных защитных свойств кожи и слизистых при тяжелой термической травме вследствие развивающейся иммуносупрессии. В имеющихся условиях на первое место должны выступать меры профилактики распространения ВБИ и формирования антибиотикорезистентности. К ним относятся:
- внедрение в практику ожоговых отделений систем очистки и кондиционирования воздуха, а также внедрение вирусно-бактериальных фильтров;
- применение одноразовых расходных материалов и белья;
- использование закрытых аспирационных систем для санации трахео-бронхиального дерева;
- переход на современные способы изоляции центральных венозных доступов от внешней среды;
- введение в практику отделений реанимации изолированных систем для сбора мочи;
- отказ от местного применения парентеральных антибактериальных препаратов и широкое внедрение современных дезинфектантов;
Кроме того, необходима непрерывно действующая система эпидемиологического надзора за внутрибольничными инфекциями, включающая следующие элементы:
- учет и регистрацию внутрибольничных инфекций;
- расшифровку их этиологической структуры;
- санитарно-бактериологические исследования объектов окружающей среды в лечебно-профилактических учреждениях, особенно в отделениях реанимации и интенсивной терапии;
- изучение циркуляции патогенных и условно-патогенных микроорганизмов;
- определение широты распространения и спектра устойчивости микроорганизмов к антибиотикам, антисептикам, дезинфектантам;
- контроль состояния здоровья медицинского персонала (заболеваемости, носительства эпидемиологически-значимых микроорганизмов);
- соблюдение санитарно-гигиенического и противоэпидемического режима в лечебно-профилактическом учреждении;
- эпидемиологический анализ заболеваемости внутрибольничными инфекциями (текущий и ретроспективный), позволяющий сделать заключение об источниках, путях и факторах передачи, а также условиях, способствующих инфицированию.
Комплексный анализ полученных данных представленной системы эпидемиологического надзора может служить основанием для планирования и проведения рациональных профилактических и противоэпидемических мероприятий в многопрофильном стационаре.
Решающим фактором в формировании высоковирулентных госпитальных штаммов возбудителей у ожогового пациента становится бессистемное назначение антибактериальных препаратов. Основная масса внутрибольничных инфекций на современном этапе вызывается условно-патогенными возбудителями. Бактериологический мониторинг у обожженных в ДГКБ № 9 проводится уже более 10 лет. Исследования выполняются как в баклаборатории стационара диско-диффузионным методом (в соответствии со стандартами NCCLS)
, так и в городском центре диагностики болезней матери и ребенка (рук. Бейкин Я.Б.) с использованием микробиологического анализатораSceptor (Becton Dickinson, США). Исследованию подвергаются раневое отделяемое, кровь, моча, экссудат трахеобронхеального дерева, удаленные магистральные катетеры.
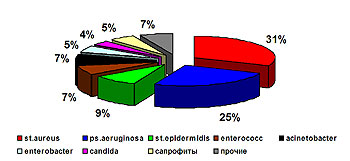
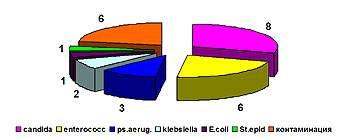
В 2004 г. было выполнено 392 исследования раневого отделяемого у 200 пациентов. В 117 (29,8%) случаев роста микрофлоры не обнаружено. Микробный пейзаж ран представлен в диаграмме (рис.1).
Рис. 1 Структура возбудителей, выделенных с ожоговой поверхности.
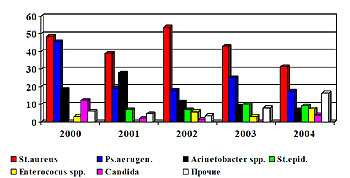
Среди выделенных возбудителей доминирует золотистый стафилококк (31%), второе место удерживает синегнойная палочка (25%), удельный вес ацинетобактера снизился с 28% в 2001 году до 7 % в 2004 г. (рис. 2).
Рис.2 Динамика структуры раневой микрофлоры в 2000-2004 гг.
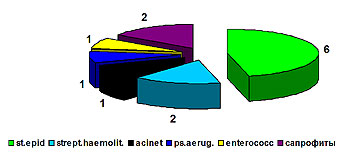
С 2004 года в клинике проводится микробиологическое исследование удаленных центральных венозных катетеров. Обнадеживает, что из 45 проб 34 (75,5%) оказались стерильными, в 6 случаях выделен эпидермальный стафилококк, в 2 – гемолитический стрептококк, в 2 – сапрофитная флора, по одному случаю пришлось на синегнойную палочку, ацинетобактер и энтерококк. (рис.3)
Рис. 3. Микрофлора центральных венозных катетеров (2004 г.)
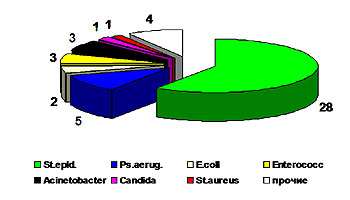
В 2004 г. выполнено 104 исследования крови у 60 пациентов. В 56 случаях (53,8%) у 35 больных (58,3%) кровь была стерильна. Распределение выделенных возбудителей представлено на рисунке 4.
Рис.4 Структура микрофлоры в гемокультурах.
Обращает на себя внимание значительное увеличение количества эпидермального стафилококка в структуре выделенных возбудителей. Этот факт требует тщательного осмысления. Первоначальное мнение о контаминации при заборах крови опровергается подтверждением изменений культуральных свойств данного возбудителя, приобретающего все большую антибиотикорезистентность.
Выделение возбудителей в гемокультурах не всегда совпадает с клиническими проявлениями сепсиса и не позволяет достоверно говорить о бактериемии или генерализации инфекции. В частности, только у одного пациента выделение в гемокультуре St. Epidermidisсовпало с высокой лихорадкой, при этом не отмечалось органной дисфункции.
Бактериологические исследования уринокультур выполнены в 2004 г. 48 больным. Из 82 проб стерильными были 55 (67,1%) у 31 пациента (64,6%). Структура возбудителей, выделенных из мочи представлена на рис.5.
Рис. 5 Структура микрофлоры, выделенной в уринокультуре.
В уринокультуре процент контаминации составил 22,2%. Наиболее значимым патогеном были грибы рода Candida (29,6%),Enterococci (22,2%) и Ps.Aeruginosae (11,1%).
Изучена антибиотикорезистентность наиболее значимых возбудителей, выделенных у пациентов с термической травмой за период нахождения их в реанимационном и ожоговом отделениях (табл.1).
Таблица 1
Соотношение (%) резистентности выделенных возбудителей
| St.aureus | St.epider | St.saproph | Ps.aerug | Enterob | Acineto | |
| РАО | 41,4 | 48 | 25 | 34,7 | 30 | 30 |
| Ожоговое отделение | 67,5 | 48 | 54,5 | 62 | 29 | 40 |
Очевиден факт роста агрессивности возбудителей по мере пребывания пациента в стационаре. Общебольничное реанимационное отделение, где пересекаются пациенты с наиболее тяжелой соматической и хирургической патологией, становится «селекционером» госпитальных штаммов. Вторым тревожным сигналом явилась высокая доля резистентности госпитальных штаммов золотистого стафилококка (41,4% и 67,5%) и синегнойной палочки (34,7% и 62%), выделенных как в РАО, так и в ожоговом отделении.
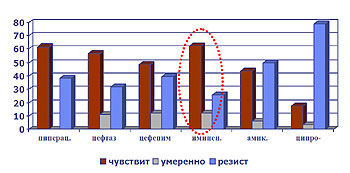
В диаграмме (риса. 6) представлена резистентность синегнойной палочки по отношению к наиболее эффективным препаратам.
Рис.6 Резистентность госпитальных штаммов Ps.aeruginosae
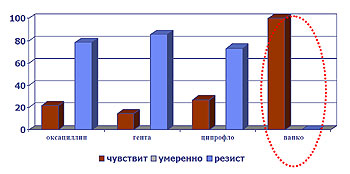
Таким образом, в отношении госпитальных штаммов синегнойной палочки наиболее эффективным препаратом на сегодняшний день остается имипенем. Резистентность госпитальных штаммов золотистого стафилококка представлена в диаграмме (рис. 7).
Рис.7 Резистентность выделенных штаммов St.aureus
Наибольшую эффективность в отношении этого возбудителя имеет ванкомицин (100%).
Третьим по значимости в нашем стационаре возбудителем в течение нескольких лет оставался Acinetobacter spp. Доля его составляла до 27%, кроме последних двух лет (менее 10%). Ацинетобактер – условно-патогенный неферментер, характеризующийся высокой природной резистентностью, что осложняет лечение возникающий инфекции. Наибольшую эффективность в отношении этого микроорганизма имеет имипенем.
Ориентируясь на вышеизложенное, нами были разработаны и внедрены организационные и тактические мероприятия, направленные на ограничение распространения госпитальной инфекции и роста резистентности возбудителей. В первую очередь, привлечено повышенное внимание администрации к проблеме госпитальных инфекций, регулярно проводятся семинары по ВБИ, обучение персонала и контроль соблюдения профилактических мер при уходе за больными.
Строгий выбор схемы импирической антибиотикотерапии на основании локальных данных — важное условие преодоления антибиотикорезистентности. Для достижения этого в клинике построена система бактериологического контроля, работает клинический фармаколог, ведется мониторинг антибиотикорезистентности, разработан, опубликован и выдан каждому лечащему врачу всего многопрофильного стационара формуляр антибактериальных препаратов. Далее приводится часть формуляра,разработанная для детей с термической травмой.
Антибиотикопрофилактика
Показания:
-длительное и травматичное оперативное вмешательство
-продленная респираторная поддержка в послеоперационном периоде (более 3 часов)
-наличие отягощающих факторов (возраст младше 3 лет, иммунодефицитные состояния, наличие очагов хронической инфекции, сопутствующих заболеваний)
Формуляр для антибиотикопрофилактики:
| Рекомендуемый препарат | Период полувыведения, час |
Дозы для детей, мг/кг/сут |
| Цефуроксим |
1,5 |
50-100 |
| Амоксициллин/клавуланат |
1-1,3 |
40-60 |
| Цефазолин |
1,5-2 |
50-100 |
Антибиотикотерапия:
Показания :
при площади ожога менее 10%
- догоспитальное время более 7 часов;
- наличие отягощенного преморбидного фона.
площадь ожога более 10% поверхности тела
наличие термоингаляционной травмы
ИВЛ
Развитие ССВО, угроза генерализации инфекции
Стартовая (эмпирическая, эскалационная) терапия:
- амоксициллин/клавуланат
- линкомицин (альтернатива)
Показания для смены антибактериального препарата:
- отсутствие положительной динамики, наличие или нарастания симптомов системной воспалительной реакции через 48-72 часа
отсутствие чувствительности выделенной флоры к используемому препарату
Второй курс антибактериальной терапии ориентирован на клиническую картину, т.к. к этому моменту бактериологические данные еще чаще всего не получены.
| Грам (+) | Грам (-) | Препараты резерва |
| Цефтриаксон+амикацин
цефотаксим+ амикацин Цефоперазон/ сульбактам Ципрофлоксацин* Пефлоксацин*
|
ЦефтазидимЦефоперазон
Цефепим Ципрофлоксацин* Пефлоксацин*
|
Имипенем/цилостатин
Меропенем
|
Стартовая деэскалационная эмпирическая терапия
Показания:
- Пациенты с ССВО, отягощенным преморбидным фоном, длительным догоспитальным временем, инфицированными ожогами
- Предполагаемая активная хирургическая тактика (ранняя некрэктомия + аутодермопластика)
| Стартовая (эмпирическая) | Альтернативная |
| Имипенем /цилостатин в/вМеропенем в/в
|
Ципрофлоксацин в/в*Пефлоксацин в/в*
|
Второй курс
|
|
|
Грам (+)
|
Грам (-)
|
| Ванкомицин в/в,в/мЛинкомицин в/м
+ Метронидазол в/в
|
Нетилмицин в/в, в/мЦефепим в/в, в/м
|
* Фторхинолоны у детей не применяются, назначение их возможно решением КЭК при отсутствии клинического эффекта от предшествующей терапии по жизненным показаниям при выделении штаммов, устойчивых к другим антибиотикам.
Эскалационная эмпирическая терапия
Показания:
- Угроза генерализации инфекции:
- Площадь ран более 30%, отказ от раннего оперативного лечения
- ТИТ
- Тяжелый шок, не купирующийся в течение 24-48 часов
- Рефрактерный шок, независимо от площади поражения
| Стартовая (эмпирическая) | Альтернативные препараты |
| Имипенем/цилостатин в/в + амикацин в/в, в/мМеропенем + амикацин в/в, в/м
|
Ванкомицин в/в капельно + метронидазол в/в (Гр(+))Цефтазидим в/в + нетилмицин в/в (Гр(-))
нетилмицин в/в + метронидазол в/в (Гр(-)) Ципрофлоксацин в/в капельно* Пефлоксацин в/в капельно*
|
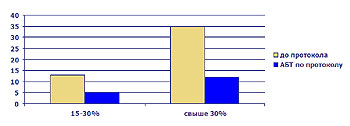
Формуляр введен в обращение в сентябре 2004 г., после чего проведен анализ эффективности АБТ. Изучены 32 клинических случая (дети с ожогами от 15 до 55% п.т.). Стартовая эмпирическая АБТ признана эффективной в 62% случаев, в 38% — неэффективна.
Критерии эффективности АБТ:
- Регресс СПОН
- Отсутствие нагноения в ране (стерильные посевы на 3,7 сутки)
- Отсутствие генерализации инфекции и вторичных очагов
При этом, в подавляющем большинстве случаев, раны оставались стерильными к 3-7 суткам. Спектр выделенных возбудителей коррелировал с эффективностью терапии: при положительном результате обнаруживались единичные колонии УПФ, с низким уровнем резистентности. При неэффективной терапии доминировала синегнойная палочка, иногда в сочетании с золотистым стафилококком.
Оценивалась частота развития местных гнойных осложнений (инфекция раны более 105 микробных тел/г ткани), септических осложнений (по клинико-лабораторным критериям), сроки лечения в стационаре. Результаты применения протокола сравнивались с аналогичными случаями термической травмы, лечение которых отличалось только подходами к эмпирической стартовой терапии.
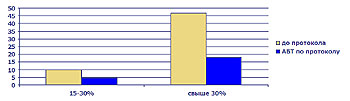
Рис 9. Частота (%) развития местных гнойных осложнений у пострадавших с различной площадью ожога.
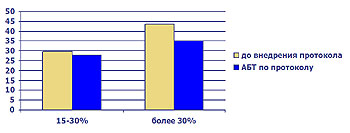
Рис.10 Частота развития (%) септических осложнений.
Рис. 11 Сравнительные средние сроки (сутки) госпитализации
Таким образом, первыми результатами работы по протоколу стали
- ротация антибактериальных средств;
- расширение спектра чувствительности госпитальных штаммов (в частности, появление чувствительности Ps.Aerug. и Acinetobacter к гентамицину, цефтазидиму);
- Снижение частоты местных гнойных осложнений в 1,5 – 2 раза
- Снижение септических осложнений в 2,5 – 3 раза
- Уменьшение времени госпитализации на 10-15%
Делать категорические выводы об эффективности предложенного метода не позволяет малое количество наблюдений, тем не менее, получен положительный результат первых месяцев внедрения формуляра.
Выводы:
- Работа по протоколу облегчает эмпирический выбор стартового препарата
- Протокол требует регулярного обновления (не реже 1 раза в 3 месяца)
- Ротация антибактериальных средств и антисептиков позволяет добиться изменения чувствительности госпитальных штаммов
- Для обеспечения эффективной АБТ необходимо:
-экспресс- диагностика чувствительности госпитальных штаммов
- экономические расчеты эффективности препаратов, предусмотренных протоколом
- изменение мышления врачей.
Литература:
1. Азолов В.В., Жегалов В.А., Дмитриев Г.И. «Термические поражения и их последствия: прошлое, настоящее и будущее» / В кн.: Мат. VI съезда травматологов и ортопедов России, Н-Новгород, 1997, 53.
2. Алексеев А.А., Крутиков М.Г., Яковлев В.П. Антибактериальная терапия в комплексном лечении и профилактике инфекционных осложнений при ожогах // РМЖ, Том 5 № 24, 1997
3. Алексеев А.А, Крутиков М.Г., Еропкина А.Г., Терехова Р.П., Гришина И.А., Елагина Л.В., Павлова В.В., Комиссарова Т.В. «Госпитальные инфекции в ожоговом стационаре» // Кл. фармакология и терапия, 1998, т.7, N 2, 57-60
4. Аспекты применения бактериовирусных фильтров в анестезиологии и реаниматологии.// Методические рекомендации. Москва, 2002.
5. Белобородов В.Б. Актуальные аспекты антимикробной терапии хирургических инфекций // Хирургия № 1, Consilium medicum, 2004.
6. Белобородова Н.В. Новые тенденции в антимикробной терапии тяжелых гнойно-воспалительных заболеваний у детей и значение антибиотиков группы карбопенемов. // Российский вестник перинатологии и педиатрии. 2002, 2, с. 56-60.
7. Еременко А.А., Зорин Д.Е. Использование фильтров дыхательного контура для профилактики ИВЛ-связанной пневмонии в ОРИТ.// Материалы VIII всероссийского съезда анестезиологов и реаниматологов. Омск, 11-15 сентября 2002 г., с.258.
8. Крутиков М.Г., Бобровников А.Э. Антибиотикопрофилактика в комбустиологии «Комбустиология», №4
9. Мельне И.О., Стасенко В.Л., Николаев С.В., Кмито Н.Л. Эпидемиологические аспекты вентилятор-ассоциированных пневмоний в неонатальном периоде.// Материалы конгресса Респираторная поддержка на рубеже XXI века. Красноярск, 2001, с.-76.
10. Руднов В.А. Выбор режимов антибактериальной терапии при нозокомиальных инфекциях в отделениях реанимации и интенсивной терапии.// Consilium medicum экстра-выпуск, 2002 г., с.3-5.
11. Руднов В.А. Формуляр антимикробных средств для отделений реанимации и интенсивной терапии // Клиническая микробиологияи антимикробная химиотерапия, №1, т.1, 1999 г.
12. Докукина Л.Н., Ахсахалян Е.Ч., Аминев В.А., Храпункова Г.Г. Формуляр антимикробных средств для детских ожоговых отделений //Актуальные проблемы термической травмы, СПб, 2002, с.343-345.
13. Асланов Б.И., Гончаров А.Е., Козулин Д.А. Перспективы использования адаптированных бактериофагов для лечения гнойно-септических инфекций, вызванных бактериями рода Acinetobacter//Актуальные проблемы термической травмы, СПб, 2002, с.168-169.
14. Грушицкая Е.В., Кондратенко Н.В., Галеева Е.В. Антибиотикопрофилактика и антибактериальная терапия у больных с глубокими ожогами // Актуальные проблемы термической травмы, СПб, 2002, с.133-135.
15. Страчунский Л.С., Козлов Р.С., Решедько Г.К. с соавт. Состояние антибиотикорезистентности грамотрицательных возбудителей нозокомиальных инфекций в отделениях интенсивной терапии.//Информационное письмо ЦНИИ эпидемиологии, 1997.
16. Хамин И.Г., Андриянова О.И., Меркулов Ю.Ю. Вентилятор-ассоциированная пневмония (ВАП) у детей.// Материалы Российского конгресса по педиатрической анестезиологии, реанимации и И.Т. Москва 24-26 сентября, 2001 г., с.- 223.
17. Яковлев С.В. Оптимизация эмпирической антибактериальной терапии жизнеугрожающих госпитальных инфекций // Consilium medicumэкстра-выпуск, 2002 г.,с.14-17.
18. Зайцев А.А. Обоснование выбора стартового антибиотика для лечения тяжелых инфекций // Consilium medicum экстра-выпуск, 2002 г., с.9-14
19. Alexander J.W. // Control of infection following burn injury. Arch. Surg., 1971, 103, 435
20. Barbara J., Chabane M.H. Retension of airborne latex particles by a bacterial and viral filter used in anaesthesia apparatus.// Anaesthesia. – 2001.-Mar; 56(3): 231-4.
21. Boisson C., Viviand X. Changing a hydrophobic heat and moisture exchanger after 48 hours rather than 24 hours: a clinical and microbiological evaluation.// Department d,Anesthesie-Reanimation, Hospital Nord, Marseilles University School of Medicine, France.
22. Broach S.D., Durbin C.G. A randomized, controlled, clinical trial of a chemically-reactive heated humidifier.// Respir. Care.- 2001.- Jan: 46 (1): 37-42.
23. Fagon J.Y., Chastre J., Hance A.J. et al. Nosocomial pneumonia in ventilated patients: a cohort stady evaluating mortality and hospital stay.// Am.J.Med.- 1993.- 94.- p. 281-8/
24. Leijten D.T., Rejger V.S., Mouton R.R. Bacterial contamination and the effect of filters in anaesthetic circus in a simulated patient model.// J.Hosp.Infect.- 1992. – May.- 21 (1): 51-60/
International Organization for Standartization 1988. Humidifiers for medical use heat and moisture exchangers. Draft International Standards (ISO/DIS 9360, 1988). International Organization for Standartization-Technical Committee 121, 1-13.
Designed by Сайт на Заказ